
【题目】硬脂酸甘油酯在碱性条件下水解的装置如图所示。进行皂化反应时的步骤如下:
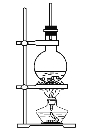
(1)在圆底烧瓶中装入7~8 g硬脂酸甘油酯,然后加入2~3 g的氢氧化钠、5 mL水、10 mL酒精。加入酒精的作用为______________________;
加入NaOH溶液的作用是___________________________。
(2)隔着石棉网给反应混合物加热约10 min,皂化反应基本完成。证明皂化反应进行完全的方法是_______________________。
(3)皂化反应完成后,加入饱和NaCl溶液的作用是____________________。
(4)图中长玻璃导管的作用为________________________。
(5)写出该反应的化学方程式:_________________________。
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 1mol甲基中含有电子数为10NA
B. 常温下,1LpH=12的Na2CO3溶液中含有的OH-离子数为0.01 NA
C. 标准状况下,NO和O2各11.2L混合充分反应,所得气体的分子总数为0.75 NA
D. 50mL12mol·L-1盐酸和足量MnO2共热,转移的电子数为0.3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水的综合利用可以制备金属镁,其流程如下图所示:
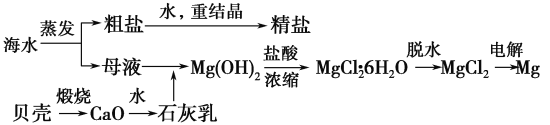
(1)Mg(OH)2沉淀中混有的Ca(OH)2应怎样除去?写出实验步骤。_______________________
(2)实验室将粗盐制成精盐的过程中,溶解、过滤、蒸发三个步骤的操作都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的:
①溶解:_____________________________。
②过滤:_____________________________。
③蒸发:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在酸性溶液中能大量共存而且为无色透明的溶液是( )
A.NH4+、Al3+、SO42﹣、NO3﹣
B.K+、Na+、NO3﹣、CO32﹣
C.K+、MnO4﹣、NH4+、NO3﹣
D.H+ , K+ , OH﹣ , NO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①25 ℃时,弱电解质的电离平衡常数:K(CH3COOH)=1.8×10-5,K(HSCN)=0.13;难溶电解质的溶度积常数:Ksp(CaF2)=6×10-10。②25 ℃时,2.0×10-3 mol/L氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:


请根据以上信息回答下列问题:
(1)25 ℃时,将20 mL 0.10 mol/L CH3COOH溶液和20 mL 0.10 mol/L HSCN溶液分别与20 mL 0.10 mol/L NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示,反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是__________,反应结束后所得两溶液中,c(CH3COO-)________c(SCN-)(填“>”、“<”或“=”)。
(2)25 ℃时,HF电离平衡常数的数值Ka≈______。
(3)4.0×10-3 mol/L HF溶液与4.0×10-4mol/L CaCl2溶液等体积混合,调节混合液pH为4.0后(忽略调节时混合液体积的变化),_______沉淀产生。(填“有”或“无”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请将符合题意的下列变化的序号填在对应的横线上:①碘的升华;②氧气溶于水;③氯化钠溶于水;④烧碱熔化;⑤氯化氢溶于水;⑥氯化铵受热分解。
(1)化学键没有被破坏的是__________;仅发生离子键破坏的是__________;
(2)即发生离子键破坏、又发生共价键破坏的是____________________;
(3)N2的电子式为__________;Na2O2的电子式为___________;CO2的电子式为_________;
(4)用电子式表示MgCl2的形成过程 _____________________;
(5)已知拆开1 mol H—H键、1 mol N≡N、1 mol N—H键分别需要吸收的能量为436 kJ、946 k J、391 k J。则由N2和H2反应生成1 mol NH3 需要放出_____的热量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器内,加入0.100 molCO气体和0.080 molCuO固体,800℃时发生如下反应:2CuO(s)+CO(g)![]() Cu2O(s)+CO2(g),n(CuO)随时间的变化如表:
Cu2O(s)+CO2(g),n(CuO)随时间的变化如表:
时间(min) | 0 | 1 | 2 | 3 | 4 | 5 |
n(CuO)(mol) | 0.080 | 0.060 | 0.040 | 0.020 | 0.020 | 0.020 |
(1)用CO表示前2min内的化学反应速率=________。
(2)计算此反应在800C时的化学平衡常数k=______________。若向平衡后的体系中加入CO和CO2各0.05mol,则此时v(正)_______v (逆) 。
(3)用来还原CuO的CO可以用C和水蒸气反应制得。
已知:C(s)+O2(g)![]() CO2(g) H =-393.5 kJ/mol,2CO(g)+ O2(g)
CO2(g) H =-393.5 kJ/mol,2CO(g)+ O2(g)![]() 2CO2(g) H=-566 kJ/mol,2H2(g)+ O2(g)
2CO2(g) H=-566 kJ/mol,2H2(g)+ O2(g)![]() 2H2O(g) H =-571.6 kJ/mol,则C(s)+H2O(g)
2H2O(g) H =-571.6 kJ/mol,则C(s)+H2O(g)![]() CO(g)+H2(g) H = __________。此反应的化学平衡表达式为:_______________________。
CO(g)+H2(g) H = __________。此反应的化学平衡表达式为:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙苯(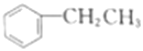 )是重要的化工原料,工业上利用乙苯可以制备苯乙烯和β-氯苯乙烷:
)是重要的化工原料,工业上利用乙苯可以制备苯乙烯和β-氯苯乙烷:
乙苯脱氢制苯乙烯:
![]() △H1=akJ/mol
△H1=akJ/mol
乙苯氯化制β-氯苯乙烷:
![]() △H2=bkJ/mol
△H2=bkJ/mol
回答下列问题:
(1)利用下表提供的数据计算a=_____。乙苯脱氢制苯乙烯的反应在_____(填“高温”或“低温”)有利于其自发进行。
化学键 | C-H | C-C | H-H | C=C |
键能/kJ/mol | 412 | 348 | 436 | 612 |
(2)已知
![]() +HCl(g)
+HCl(g)![]()
![]() △H=-54kJ/mol
△H=-54kJ/mol
H2(g)+Cl2(g)=2HCl(g) △H=-185kJ/mol 则b=______________。
(3)T℃,将nmol乙苯加入到体积为V L的恒容容器中,发生脱氢反应,容器内压强随时间变化如下表所示:
时间/min | 0 | 10 | 20 | 30 | 40 |
压强/×100 kPa | 1.0 | 1.2 | 1.3 | 1.4 | 1.4 |
平衡时容器内气体的总物质的量为______,乙苯的转化率为______%。
(4)工业由乙苯脱氢制苯乙烯实际上是在恒压密闭容器中进行的。将m mol乙苯通入某恒压密闭容器中(反应过程中维持压强为p),乙苯的平衡转化率随温度变化如右图所示:
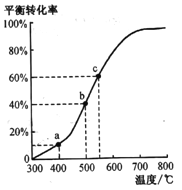
①在a点所示的条件下,向该容器中通入25L水蒸气,则乙苯的转化率______(填“变大”“变小”或不变),生成苯乙烯的速率________(填“变大”“变小”或不变)。
②b点气体总体积______(填“<”“>”或“=”)c 点气体总体积。
③c点平衡常数Kp=_______(用平衡分压代替平衡浓度,平衡分压=物质的量分数×总压)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com