
| A、波义耳 | B、拉瓦锡 |
| C、道尔顿 | D、门捷列夫 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、①②⑥ | B、②③⑥ |
| C、②⑤⑥ | D、②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CaCl2=Ca2++2Cl- |
| B、NaHSO4=Na++H++SO42- |
| C、HNO3=H++NO3- |
| D、KOH=K++O2-+H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③⑥⑧ |
| B、②③⑤⑦⑧ |
| C、②③⑤⑥⑦ |
| D、②③④⑥⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 I.科学家最近在-100℃的低温下合成了一种烃X,经红外光谱和核磁共振表明其分子中的氢原子的化学环境没有区别,根据分析,绘制了如图所示的球棍模型.下列说法中错误的是
I.科学家最近在-100℃的低温下合成了一种烃X,经红外光谱和核磁共振表明其分子中的氢原子的化学环境没有区别,根据分析,绘制了如图所示的球棍模型.下列说法中错误的是查看答案和解析>>
科目:高中化学 来源: 题型:
2- 4 |
| O | 2- 4 |
| O | 2- 4 |
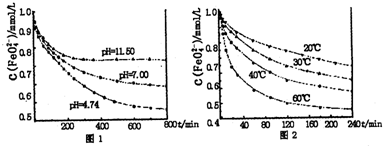
| O | 2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
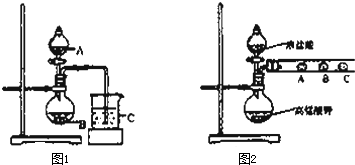
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com