
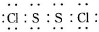 �������ȶ�����ˮ�������
�������ȶ�����ˮ�������| ���� | S | CS2 | CCl4 | S2Cl2 |
| �е�/�� | 445 | 47 | 77 | 137 |
| �۵�/�� | 113 | -109 | -23 | -77 |
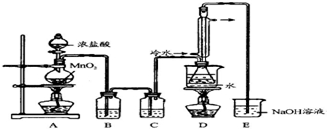
���� ��1������ʵ�����Ʊ������ķ����������ö������̺�Ũ������ȷ�Ӧ����������
��2���������̺�ϡ����֮�伸������Ӧ��
��3���������ʵ��Ʊ�ʵ����װ�õ��������ش�
��4�������е�HCl�Լ�ˮ����Ӧ�ó�ȥ�����ݱ������ʵķе�ߵͿ��Խ������ʵķ��룻
��5��ʵ���еĴ��������Լ�ʵ������İ�ȫ��ʩҪ����ע�⣻
��6�����������Ϣ��S2Cl2��ˮ������᪻���Ӧ����д��Ӧ����ʽ�������Ի����£������Ӻʹ����������֮����Է������з�Ӧ�õ��������ݴ˻ش�
��� �⣺��ȡԭ���ǣ���ʾ�������̺�Ũ����֮�䷴Ӧ�õ����������������л���HCl��ˮ��Ӧ�����ñ���ʳ��ˮ��ȥHCl������Ũ���������������������
����̼��һ���¶��·�����Ӧ��CS2+3Cl2$\stackrel{111-140��}{��}$CCl4+S2Cl2��Ϊ��ʹCS2ƽ���������������S2Cl2������������ˮԡ���ȵķ���������S2Cl2��
�۷е����ݣ��������������İ취��֮�ռ����������е�����Ҫ����β���������������������������գ�
��1���ù�Һ���ȵķ�����Cl2������Ũ����Ͷ������̷�Ӧ��ȡ����Ӧ���ӷ���ʽΪ��MnO2+4H++2Cl-$\frac{\underline{\;\;��\;\;}}{\;}$Mn2++Cl2��+2H2O��
�ʴ�Ϊ��MnO2+4H++2Cl-$\frac{\underline{\;\;��\;\;}}{\;}$Mn2++Cl2��+2H2O��
��2��ʵ��������ͨ������36.5%��Ũ��Һ������ϡ���ᣬ��Ϊϡ���ỹԭ��������Ӧ���ѣ�
�ʴ�Ϊ��ϡ���ỹԭ��������Ӧ���ѣ�
��3��D����������������������˫�����ã�����������ȡ�����������屽��ʯ�ͷ�����������õõ���
�ʴ�Ϊ��ACD��
��4����ȡ����ʱ�����е�HCl����Ӧ���ñ���ʳ��ˮ��ȥ�����ݱ������ʵķе�ߵͣ�Ϊ��ʹCS2ƽ���������������S2Cl2���������Բ���ˮԡ���ȵķ��������������ƿ�ڻ�����з����S2Cl2�ķ������������¶���
137�棬�ʴ�Ϊ������ʳ��ˮ������ʹCS2ƽ���������������S2Cl2������
��5��Aװ������װ��ʱ������װ��װ����Ϻ�Ӧ�Ƚ��������Եļ�飬�������Լ���ʵ����ϣ����װ��ʱ��Ϊ��ֹ������Ӧ�Ƚ�E�г������ƿ�Һ�棬
�ʴ�Ϊ�������Լ�飻��ֹ������
��6��S2Cl2��ˮ��Ӧ������ɫ�̼�����ζ������������л�ɫ�������ɣ���ɫ�̼�����ζ������Ȼ����⣬����������ԭ��Ӧ��Ԫ�ػ��ϼ۱仯�غ��ƶϣ����ϼ۽��͵����ɻ�ɫ����Ϊ�������ϼ����ߵ����ɶ����������壬����ԭ���غ㡢�����غ�д����ѧ����ʽΪ��2S2Cl2+2H2O=3S��+SO2��+4HCl��������������������������Һ�к����Ȼ��ơ��������ƣ������м���Ũ���ᣬ�������Ի����£������Ӻʹ����������֮����Է������з�Ӧ�õ���������ӦΪ��ClO-+2H++Cl-=Cl2��+H2O��
�ʴ�Ϊ��2S2Cl2+2H2O=3S��+SO2��+4HCl����ClO-+2H++Cl-=Cl2��+H2O��
���� ���⿼��������ʵ�����Ʊ�����������������ӵ�װ��ѡ����Լ�ѡ�������Ϣ��Ӧ�÷���������ʽ��д����ѧ����ʽ��д��������������ķ����жϣ���Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| A | B | C | D | |
| SO3 | 0mol | 4mol | 2mol | 0mol |
| SO2 | 4mol | 1.5mol | 0mol | 4mol |
| O2 | 2mol | 0mol | 0mol | 4mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ķ���ʽ��P | B�� | ������Ľṹʽ��H-Cl-O | ||
| C�� | �����ӵĽṹʾ��ͼ�� | D�� | ��������ĵ���ʽ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ͨ��ˮ�У�Cl2+H2O?2H++Cl-+ClO- | |
| B�� | KI��Һ��H2SO4�ữ��H2O2��Һ��ϣ�2 I-+H2O2+2 H+=2 H2O+I2 | |
| C�� | ��NH4HCO3��Һ�еμӹ���Ba��OH��2��Һ��HCO3-+OH-+Ba2+=H2O+BaCO3�� | |
| D�� | �������������Һ���ն�������SO2+MnO4-+4H+=SO42-+Mn2++2H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CO2���ӱ���ģ�ͣ�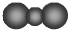 | |
| B�� | ����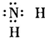 | |
| C�� | ԭ�ӽṹʾ��ͼ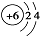 ��ʾ12C��Ҳ���Ա�ʾ14C ��ʾ12C��Ҳ���Ա�ʾ14C | |
| D�� | ��Ȳ�����ʽ CH��CH |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������ģ�ͣ�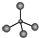 | B�� | �ǻ��ĵ���ʽ��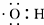 | ||
| C�� | ��ȩ�Ľṹʽ��CH3CHO | D�� | ����Ľṹ��ʽC2H4O2 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com