
| A、6.4g | B、4.8g | C、2.4g | D、1.6g |
| ||
| 1 |
| 2 |
| ||


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
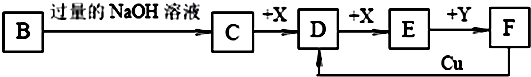
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为元素周期表中第四周期的部分元素(从左到右按原子序数递增排列),根据要求回答下列各小题:
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge |
(1)在以上元素的基态原子的电子排布中4s轨道上只有1个电子的元素有 (填元素名称)。
(2)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域:s区、p区、d区、ds区和f区,以上十二种元素分别属于s区、d区和ds区,则属于s区的元素有 种,属于d区的元素有 种。
(3)试比较:第一电离能I1(Cr) I1(Co)(填“>”、“<”或“=”,下同);
晶格能U(FeO) U(NaCl)(FeO与NaCl的晶胞结构相似)。
(4)钇钡铜氧是一种新型节能高温超导体,其晶胞结构如下图所示,研究发现,此高温超导体中的Cu元素有两种价态,分别为+2价和+3价,Y元素的化合价为+3价,Ba元素的化合价为+2价。

①该物质的化学式为: 。
②该物质中Cu2+与Cu3+的原子个数比为: 。
(5)现有一种含钛的晶体,其组成为TiCl3?6H2O,晶体中Ti3+的配位数为6。为测定该晶体的化学式,进行了如下实验:取一定质量的该晶体(含0.01molTi3+)配成溶液,向其中滴入足量AgNO3溶液,产生白色沉淀,沉淀完全后过滤,经洗涤干燥后称量,质量为2.87g。试推断紫色晶体的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
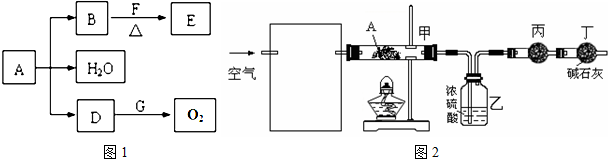
已知A、B、D、E、F、G为中学化学中常见的化合物,它们之间有如图所示的转化关系(反应条件及部分产物已略去)。A为绿色粉末,含H、C、O、Cu四种元素。常温下,D为无色无味气体,B为黑色粉末,E分子结构中含有醛基。
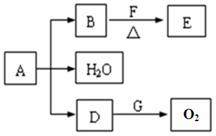
请回答下列问题:
(1)D跟G反应的化学方程式 。
(2)F中一定含有的官能团名称 。
(3)某课外小组设计了下列实验装置,通过测定装置甲和乙中试剂的质量变化,探究A的化学式。

①为使数据准确,还需补充装置,请你在方框内绘出装置图并写出试剂名称。
②向装置中鼓入空气的目的是 ;丙装置中药品的名称是 ,实验时,该药品未见明显变化,证明 。
③如何判断A已完全分解? 。
④实验测得出如下数据:A受热后完全分解,固体由8.0 g变为6.0 g,装置乙增重0.9 g。写出A的化学式(表示为碱式盐): 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com