
| A、Na+、Ca2+、SO42-、Cl- |
| B、H+、Mg2+、CO32-、S2- |
| C、K+、Mg2+、SO42-、NO3- |
| D、K+、Na+、NO3-、SO32- |


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
| A、盐酸 氢氧化钠 碳酸钠 硫酸铜 |
| B、盐酸 硝酸银 氯化钠 硝酸钠 |
| C、氢氧化钠 硫酸镁 氯化钠 盐酸 |
| D、氯化钡 硫酸钠 氯化钙 硝酸钙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

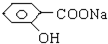
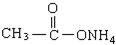
| A、全部 | B、仅①②③④ |
| C、仅①④⑤ | D、仅①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 35 | 50 | 60 | 70 | 80 |
| 温度/℃ | 25 | 26 | 26 | 26 | 26 | 26 | 26.5 | 27 | 27 | 27 | 27 |
| 实验 编号 | 铜片 质量/g | 0.1mol?L-1的 硝酸体积/mL | 硝酸铜 晶体/g | 亚硝酸钠 晶体/g | 实验目的 |
| ① | 5 | 20 | 0 | 0 | 实验①和②探究 |
| ② | 5 | 20 | 0.5 | 0 | |
| ③ | 5 | 20 | 0 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可用半透膜除去淀粉溶液中的少量NaCl |
| B、黄河入海口容易形成沙洲 |
| C、将植物油倒入水中用力搅拌可形成油水混合物 |
| D、一束平行光线通过蛋白质溶液,从侧面可以看到一条光亮的通路 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com