
分析 (1)根据题意可知,氧血红蛋白(HbO2)的生成速率=2.1×106L•mol-1•s-1×1.6×10-6 mol•L-1×8×10-6 mol•L-1=2.69×10-5mol/(L•s);
(2)根据v=k•c(A)a•c(B)b,1.1×10-4 L•mol-1•s-1=2.1×106L•mol-1•s-1•c(O2)•8×10-6 mol•L-1,计算氧气的浓度;
血液中氧浓度与进入肺的氧分压成正比,可以增大氧气的进入量,措施为吸入富氧空气或纯氧.
解答 解:(1)根据题意可知,氧血红蛋白(HbO2)的生成速率=2.1×106L•mol-1•s-1×1.6×10-6 mol•L-1×8×10-6 mol•L-1=2.69×10-5mol/(L•s),故答案为:2.69×10-5mol/(L•s);
(2)根据v=k•c(A)a•c(B)b,1.1×10-4 L•mol-1•s-1=2.1×106L•mol-1•s-1•c(O2)•8×10-6 mol•L-1,血液中氧浓度与进入肺的氧分压成正比,可以增大氧气的进入量,措施为吸入富氧空气或纯氧,故答案为:6.55×10-6mol/L;让病人吸入富氧空气或纯氧.
点评 本题结合生活实际考查了学生阅读信息提取信息解决问题的能力,根据速率常数的公式进行计算,难度不大,重在理解题目的思路.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:选择题
| A. | 19gNHD2和19gNH2T中含有的中子数均为9NA | |
| B. | 1molCnH2n+2中含有的共用电子对数为(3n+1)NA | |
| C. | 2 mol Na2O2有的阴离子数为4NA | |
| D. | 2 mol SO2和1 molO2在一定条件下充分反应后,所得混合气体的分子数大于2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
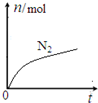 某离子反应中涉及到H、O、Cl、N四种元素形成的六种微粒,N2、H2O、ClO-、H+、NH4+、Cl-,其中N2的物质的量随时间变化的曲线如图所示:
某离子反应中涉及到H、O、Cl、N四种元素形成的六种微粒,N2、H2O、ClO-、H+、NH4+、Cl-,其中N2的物质的量随时间变化的曲线如图所示: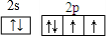 ,该化学用语不能表达出氧原子最外层电子的c(填序号).
,该化学用语不能表达出氧原子最外层电子的c(填序号).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
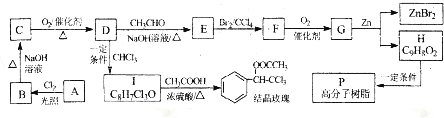
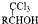
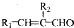 (R、R1、R2代表烃基或氢原子)
(R、R1、R2代表烃基或氢原子)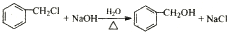 ;
;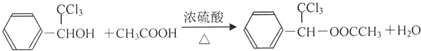 ;
;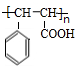 ;
;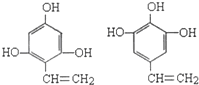 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能大量存在:Na+、C6H5O-、Cl-、Br- | |
| B. | 同温下通入少量的氨气:NH4+的水解能力增强,Kw增大,有白色沉淀产生 | |
| C. | 加入Ba(OH)2溶液生成沉淀质量最多的离子方程式:NH4++Al3++2Ba2++5OH-+2SO42-=2BaSO4↓+AlO2-+NH3•H2O+2H2O | |
| D. | 其浓溶液可与NaHCO3溶液混合制成灭火器 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
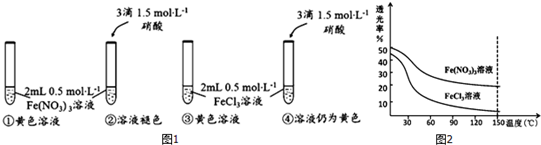
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
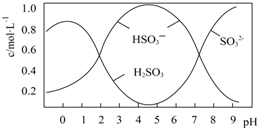 葡萄酒常用Na2S2O5做抗氧化剂,25℃时,将0.5molNa2S2O5溶于水配成1L溶液,该溶液pH=4.5,溶液中部分微粒不正确的是( )
葡萄酒常用Na2S2O5做抗氧化剂,25℃时,将0.5molNa2S2O5溶于水配成1L溶液,该溶液pH=4.5,溶液中部分微粒不正确的是( )| A. | Na2S2O5溶于水的化学方程式:Na2S2O5+H2O=2NaHSO3 | |
| B. | 由图形可知,25℃时,HSO3-的水解平衡常数约为10-12 | |
| C. | 当溶液pH小于0.5后,图中曲线变化的原因可能是H2SO3被部分氧化 | |
| D. | 向溶液中加入碱性物质使溶液pH升高的过程中,一定存在如下关系:c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
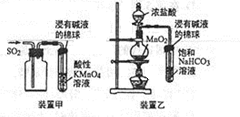
| A. | 用装置甲收集SO2并验证其漂白性 | |
| B. | 用装置乙验证氯气与水反应有盐酸生成 | |
| C. | 用澄清石灰水鉴别苏打溶液和小苏打溶液,出现白色沉淀的为苏打溶液 | |
| D. | 向足量含淀粉的Fel2溶液中滴加2滴新制氯水,溶液变蓝,说明还原性:I->Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com