
| A. | 硅是构成一些岩石和矿物的基本元素,单质硅是良好的半导体材料 | |
| B. | 水泥、玻璃、水晶饰物都硅酸盐制品 | |
| C. | 玻璃是氧化物,成分可表示为Na2O•CaO•6SiO2 | |
| D. | 硅酸钠的水溶液俗称水玻璃,是制备硅胶和木材防火剂等的原料 |
分析 A、硅的氧化物和硅酸盐构成了地壳中的大部分岩石,硅是构成一些岩石和矿物的基本元素;
B、水晶的主要成分是二氧化硅;
C、玻璃的成分判断;
D、硅酸钠与酸反应制备硅胶,硅酸钠溶液是矿物胶,不燃烧,阻隔木材与空气中氧气的直接接触.
解答 解:A、硅是亲氧元素,在自然界中它总是和氧相互化合的,硅的氧化物和硅酸盐构成了地壳中的大部分岩石,硅是构成一些岩石和矿物的基本元素,单质硅是良好的半导体材料,故A正确;
B、水泥、玻璃是硅酸盐产品,水晶的主要成分是二氧化硅,故B错误;
C、玻璃是混合物不是氧化物,主要是硅酸钠、硅酸钙、石英的混合物,成分可用氧化物的形式表示为Na2O•CaO•6SiO2,故C错误;
D、硅酸钠与酸反应生成硅酸,可以制备硅胶,硅酸钠溶液是矿物胶,不燃烧,而将硅酸钠涂在木材表面就阻隔了木材与空气中氧气的直接接触,可用作制备木材防火剂的原料,故D正确,
故选AD.
点评 本题考查硅及硅的化合物,难度不大,注意陶瓷、水泥、玻璃是硅酸盐产品.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa) | |
| B. | pH=5的①NH4Cl溶液②CH3COOH溶液③盐酸溶液中由水电离出的c(H+):①>②>③ | |
| C. | 等体积pH=12的NaOH溶液和pH=2的CH3COOH溶液混合,混合后溶液pH<7 | |
| D. | 0.1mol•L-1的CH3COOH溶液pH=a,0.01mol•L-1的CH3COOH溶液pH=b,则b<a+1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
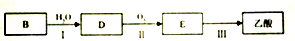
| A. | 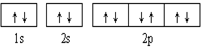 可表示单核10电子粒子基态时电子排布 可表示单核10电子粒子基态时电子排布 | |
| B. | 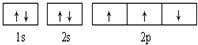 此图错误,违背了泡利原理 此图错误,违背了泡利原理 | |
| C. | 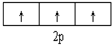 表示基态N原子的价电子排布 表示基态N原子的价电子排布 | |
| D. |  表示处于激发态的B的电子排布图 表示处于激发态的B的电子排布图 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 高中化学教材介绍了钠、镁、铝、铁、氯、硫、氮、硅等元素及其化合物的知识,是学习研究其它化学知识的载体.
高中化学教材介绍了钠、镁、铝、铁、氯、硫、氮、硅等元素及其化合物的知识,是学习研究其它化学知识的载体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
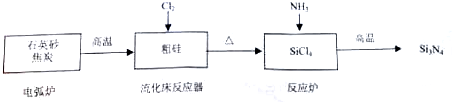
| 物质 | Si | SiCl4 | Cl2 |
| 沸点/℃ | 2355 | 57.6 | -34.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 300 | 500 | 830 |
| 平衡常数K | 12 | 9 | 1 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠是银白色、有一定延展性的金属,硬度很大 | |
| B. | 将钠放在石棉网用酒精灯加热,钠剧烈燃烧,产生黄色火焰,生成过氧化钠 | |
| C. | 金属钠在空气中燃烧,因氧气浓度低,生成氧化钠 | |
| D. | 钠保存在煤油中,也可保存在CCl4中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L Na2CO3溶液:C(Na+)=2[c(HCO3-)+c(CO32-)+c(H2CO3)] | |
| B. | 0.1 mol/L NH4Cl溶液:C(NH4+ )=C(Cl-) | |
| C. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:C(Na+)>C(CH3COO-)>C(H+)>C(OH-) | |
| D. | 向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:C(Na+)>C(NO3-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com