
| A、所有原子在同一平面内 |
| B、分子中不含有氢原子 |
| C、A的化合价的数值等于其最外层电子数 |
| D、分子结构对称 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 化学式 | NH3?H2O | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×l0-5 | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7, K2=5.6×l0-11 |
| A、0.1mol?L-1 CH3COONa溶液显碱性,0.1mol?L-1 CH3COONH4溶液显中性 |
| B、等物质的量浓度的NaHCO3和NaCN溶液,前者溶液中水的电离程度大 |
| C、NaCN+H2O+CO2(少量)=HCN+NaHCO3 |
| D、上述3种等体积等pH的酸溶液,分别加水稀释后pH仍相等,则醋酸中加入水的体积最少 |
查看答案和解析>>
科目:高中化学 来源: 题型:
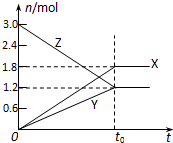 在一定温度下,将一定量的气体通入体积为2L的密闭容器中,使其发生反应,t0时容器中达到化学平衡,有关物质X、Y、Z的物质的量的变化如图所示.则下列有关推断正确的是( )
在一定温度下,将一定量的气体通入体积为2L的密闭容器中,使其发生反应,t0时容器中达到化学平衡,有关物质X、Y、Z的物质的量的变化如图所示.则下列有关推断正确的是( )| A、该反应的化学方程式为:3Z?3X+2Y |
| B、达到平衡时,X、Y、Z的质量不再改变 |
| C、达到平衡时,Z的浓度为1.2mol/L |
| D、达到平衡后,反应停止,反应速率为0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、高聚物脲醛树脂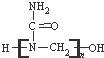 的合成单体之一是CH3OH 的合成单体之一是CH3OH |
B、按系统命名法,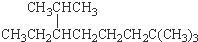 的名称为2,7,7-三甲基-3-乙基辛烷 的名称为2,7,7-三甲基-3-乙基辛烷 |
| C、有一种信息素的结构简式为CH3(CH2)5CH═CH(CH2)9CHO,为验证该物质中既含有醛基又含有碳碳双键,向该物质的试液中先加溴的CCl4溶液,观察到溶液褪色,继续滴加直到溶液变为红棕色,再向溶液中加入0.5mL H2O,充分振荡,观察到溶液褪色 |
D、化合物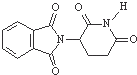 的分子式为C13H8O4N2 的分子式为C13H8O4N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去SO42-最合适的试剂是BaCl2 |
| B、工业上通过电解氯化钠溶液制备金属钠和氯气 |
| C、室温下,AgCl在水中的溶解度大于在食盐水中的溶解度 |
| D、用酚酞试液可鉴别饱和食盐水和饱和纯碱溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、纸层析法分离铁离子和铜离子的实验中,应沿试管壁小心地将展开剂慢慢倒入试管底部 |
| B、硫酸铜溶液中加入过量浓氨水,最终溶液中出现大量淡蓝色絮状沉淀 |
| C、在氯化铝溶液中分别加入过量的氢氧化钠溶液和浓氨水,均可形成铝的配合物Al(OH)4- |
| D、在盛有氯化钴溶液的试管中,加入一定量的浓盐酸,溶液的颜色由粉红色变为蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
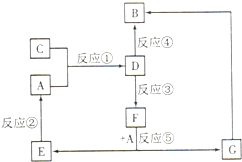 A、B、C、D、E、F、G七种物质间存在如图所示的转化关系,其中A、B、D、G含有同种元素.已知:
A、B、C、D、E、F、G七种物质间存在如图所示的转化关系,其中A、B、D、G含有同种元素.已知:| 实验步骤 | 实验现象 | 写离子方程式 |
| 将少量气体通入淀粉KI溶液 | 溶液最初变成 | |
| 继续通入气体 | 溶液逐渐变成无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
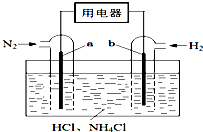 使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液,可制造出一种既能提供电能,又能实现氮固定的新型燃料电池,原理如右图所示.下列有关分析正确的是( )
使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液,可制造出一种既能提供电能,又能实现氮固定的新型燃料电池,原理如右图所示.下列有关分析正确的是( )| A、a为电池的负极 |
| B、通入N2一极的电极反应式为:N2+6e-+8H+═2NH4+ |
| C、电池工作一段时间后,溶液pH减小 |
| D、电流的方向是由b经用电器到a |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com