
分析 当钢铁表面的水膜呈弱酸性或中性时,钢和碳形成原电池,铁做负极,碳做正极,氧气在正极上放电,据此分析.
解答 解:当钢铁表面的水膜呈弱酸性或中性时,钢和碳形成原电池,铁做负极,碳做正极,氧气在正极上放电,即吸氧腐蚀的实质是铁在水膜的存在下被氧气氧化,这种腐蚀过程是因为吸收了氧气而铁被腐蚀的过程,即铁在负极失去电子,电极反应为Fe-2e-=Fe2+,正极上吸收的氧气放电,正极反应为O2+4e-+2H2O=4OH-,故答案为:水;氧气;氧气;O2+4e-+2H2O=4OH-;Fe-2e-=Fe2+.
点评 本题考查了钢铁的吸氧腐蚀,难度不大,应注意的是钢铁发生吸氧腐蚀的条件是水膜呈弱酸性或中性.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源:2017届安徽省黄山市高三上月考二化学卷(解析版) 题型:填空题
汽车尾气中的主要污染物是NO和CO。为减轻大气污染,人们提出通过以下反应来处理汽车尾气:
(1 )2NO(g)+2CO(g)
)2NO(g)+2CO(g) 2CO2(g)+N2(g)△H=﹣746.5kJ•mol-1(条件为使用催化剂)
2CO2(g)+N2(g)△H=﹣746.5kJ•mol-1(条件为使用催化剂)
已知:2C(s)+O2(g) 2CO(g)△H=﹣221.0kJ•mol-1
2CO(g)△H=﹣221.0kJ•mol-1
C(s)+O2(g) CO2(g)△H=﹣393.5kJ•mol-1
CO2(g)△H=﹣393.5kJ•mol-1
则N2(g)+O2(g)=2NO(g) △H = kJ•mol-1。
(2)T ℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/10-4 mol/L | 10.0 | 4.50 | c1 | 1.50 | 1.00 | 1.00 |
c(CO)/10-3 mol/L | 3.60 | 3.05 | c2 | 2.75 | 2.70 | 2.70 |
则c2合理的数值为 (填字母标号)。
A.4.20 B.4.00 C.2.95 D.2.80
(3)将不同物质的量的H2O(g)和CO(g)分别通入体积为2 L的恒容密闭容器中,进行反应:H2O(g)+CO(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | CO | H2 | |||
i | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
ii | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
iii | 900 | a | b | c | d | t |
若a=2,b=1,则c= ,达平衡时实验组ii中H2O(g)和实验组iii中CO的转化率的关系为αii(H2O) αiii(CO)(填“<”、“>”或“=”)。
(4)二甲醚是清洁能源,用CO在催化剂存在下制备二甲醚的反应原理为:2CO(g)+4H2(g) CH3OCH3(g)+H2O(g),已知一定条件下,该反应中CO的平衡转化率随温度、投料比
CH3OCH3(g)+H2O(g),已知一定条件下,该反应中CO的平衡转化率随温度、投料比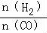 的变化曲线如图1所示。
的变化曲线如图1所示。

① a、b、c按从大到小的顺序排序为 。
② 根据图象可以判断该反应为 反应(填吸热或放热)。
(5)CO分析仪的传感器可测定汽车尾气是否符合排放标准,该分析仪的工作原理类似于燃料电池 ,其中电解质是氧化钇(Y2O3)和氧化锆(ZrO2)晶体,能传导O2-。
,其中电解质是氧化钇(Y2O3)和氧化锆(ZrO2)晶体,能传导O2-。
① 负极的电极反应式为 。
② 以上述电池为电源,通过导线连接成图2。若X、Y为石墨,a为2 L 0.1 mol/L KCl溶液电解一段时间后,取25 mL 上述电解后的溶液,滴加0.4 mol/L醋酸得到图3曲线(不考虑能量损失和气体溶于水,溶液体积变化忽略不计)。根据图2计算,上述电解过程中消耗一氧化碳的质量为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 前10min反应的平均速率v(C)=0.1 mol/(L•min) | |
| B. | 反应达到平衡时B的平衡浓度是1.5 mol•L-1 | |
| C. | 恒温下,将反应容器体积压缩为原来的一半,则D的平衡浓度小于1.0 mol•L-1 | |
| D. | 10 min后在容器中加入A,重新建立平衡时A的转化率一定大于50% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{2}$N2H4(g)+$\frac{1}{2}$O2(g)═$\frac{1}{2}$N2(g)+H2O(l)△H=-267 kJ•mol-1 | |
| B. | N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-133.5 kJ•mol-1 | |
| C. | N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=+534 kJ•mol-1 | |
| D. | N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大压强或降低温度,平衡常数K都增大 | |
| B. | 其它条件相同,向容器中只加入2molZ,能建立完全相同的平衡状态 | |
| C. | 平衡时,平衡常数K=36a(mol/L)-1 | |
| D. | 某时刻X、Y、Z物质的量分别是0.3mol,1mol和1.1mol,反应正向进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com