
����Ŀ��ij�������ֻ������Ե����̼�������缫���ϣ�������ZnSO4��Һ���л��߾�������̬����ʣ������ܷ�ӦΪMnO2+![]() Zn+(1+
Zn+(1+![]() )H2O+
)H2O+![]() ZnSO4
ZnSO4![]() MnOOH+
MnOOH+![]() ZnSO4[Zn(OH)2]3��xH2O.���ؽṹ��ͼ1��ʾ��ͼ2���л��߾���ĽṹƬ�Ρ�����˵���У�����ȷ���ǣ� ��
ZnSO4[Zn(OH)2]3��xH2O.���ؽṹ��ͼ1��ʾ��ͼ2���л��߾���ĽṹƬ�Ρ�����˵���У�����ȷ���ǣ� ��
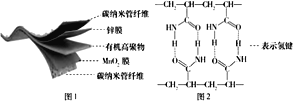
A.̼���ܾ��е����ԣ��������缫����
B.�ŵ�ʱ��Zn2+����MnO2Ĥ
C.���ʱ����ص�������ӦΪMnOOH+e- =MnO2 + OH-
D.�л��߾���ĵ���![]() �к���̼̼˫��
�к���̼̼˫��
���𰸡�C
��������
A.�õ����̼�������缫���ϣ���֪̼���ܾ��е����ԣ�ѡ��A��ȷ��
B.�ŵ�ʱ��װ��Ϊԭ��أ���������������������Zn2+����MnO2Ĥ��ѡ��B��ȷ��
C.���ʱ��ص���������ʧ���ӵ�������Ӧ����缫��ӦʽΪ��MnOOH-e-+OH-=MnO2+H2O��ѡ��C����.
D.���ݸ߾���Ľṹ��Ԫ���ø߾���Ϊ�Ӿ۲���ϳ��л��߾���ĵ����ǣ�CH2=CH-CO-NH2������̼̼˫��,ѡ��D��ȷ��
��ѡC��


 �������¿��ÿ�ʱ��ҵϵ�д�
�������¿��ÿ�ʱ��ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����з�Ӧ��ƽ�ⳣ������ֵ���£�
2NO(g)![]() N2(g)+O2(g)��K1=1��1030��
N2(g)+O2(g)��K1=1��1030��
2H2(g)+O2(g)![]() 2H2O(g)��K2=2��1081��
2H2O(g)��K2=2��1081��
2CO2(g)![]() 2CO(g)+O2(g)��K3=4��10��92��
2CO(g)+O2(g)��K3=4��10��92��
����˵����ȷ���ǣ� ��
A.�����£�NO�ֽ����O2�ķ�Ӧ��ƽ�ⳣ������ʽΪK1=c(N2)��c(O2)
B.�����£�ˮ�ֽ����O2����ʱƽ�ⳣ������ֵԼΪ5��10-82
C.�����£�NO��H2O��CO2���ֻ�����ֽ�ų�O2�������ɴ�С��˳��ΪNO>H2O>CO2
D.����˵��������ȷ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������п�������Ļ��Լ�����ǿ����������п��ƷΪԭ���Ʊ���������п�����������������£�
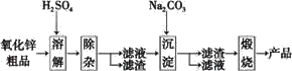
һЩ������������������ʽ��ȫ����ʱ��Һ��pH���±���

��1�����ܽ⡱ǰ������п��Ʒ�����ϸ������Ŀ����_____��
��2�����ܽ⡱��õ���������Һ�к���Zn2+��SO42-��������Fe2+��Cu2+�����ʡ��ȼ���____(�Na2CO3����H2SO4��)������Һ��pH��5.4��Ȼ���������KMnO4��Fe2+ת��ΪFe(OH)3��ͬʱKMnO4ת��ΪMnO2���������Һ��Fe2+��Ũ��Ϊ0.009mol��L-1����ÿ����Һ������Ӧ����__molKMnO4��
��3������Cu2+�������û���Ӧ��ȥ��Ӧѡ���������_____��
��4�����������õ�ZnCO3��2Zn(OH)2��H2O�������ա���450�桫500���½��У������ա���Ӧ�Ļ�ѧ����ʽΪ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ����֪Ũ�ȵ��������ⶨij����������Ʒ�Ĵ��ȣ���־�����뷴Ӧ�����Ը���ʵ��ش��������⣺
��1��ȷ����5.0 g���������������ʵ���Ʒ�����1L������Һ������ʱ����Ʒ�ɷ���________(����ĸ)������
A.С�ձ��С������� B.�ྻֽƬ�ϡ����� C.������
��2���ζ�ʱ����0.100 0 mol��L��1���������ζ�������Һ����ѡ��________��ָʾ����
A.���� B.ʯ�� C.��̪
��3���ζ�����������������Һ������ƿ�У�������Ӧ�÷���_______����ס����ҡ����С���ͬѧѡ�÷�̪��ָʾ��������жϴﵽ�ζ��յ㣺_______________________________��
��4�������±����ݣ����㱻���ռ���Һ�����ʵ���Ũ����______________ mol��L��1���ռ���Ʒ�Ĵ�����_______________��
�ζ����� | ������Һ ���(mL) | ������� | |
�ζ�ǰ�Ŀ̶�(mL) | �ζ���Ŀ̶�(mL) | ||
��һ�� | 10.00 | 0.40 | 10.50 |
�ڶ��� | 10.00 | 4.10 | 14.00 |
������ | 10.00 | 2.50 | 14.00 |
��5������ʵ�������Եζ��������ʲô�����(����ƫ������ƫ����������Ӱ����)
���۲���ʽ�ζ���Һ��ʱ����ʼƽ�ӣ��ζ��յ㸩�ӣ���ζ����______________��
���ζ�ǰ��ʽ�ζ��ܼ��촦�����ݣ��ζ���������ʧ����ζ����______________��
��ϴ�Ӻ���ƿδ�����ζ����______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һƿ���õ�Na2SO3(����ֻ��Na2SO4)��Ϊ�˲ⶨ�䴿�ȣ�ȡ��Ʒ5.0 g���100 mL��Һ��ȡ����25.00 mL����ƿ�У���0.10 molL-1����KMnO4��Һ���еζ������յ�ʱ����KMnO4��Һ20.00 mL�������Ʒ�Ĵ��ȡ�_______________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�����0.1 mol/L��NH4HCO3��Һ��pH =7.8����֪��������̼�������ķֲ�������ƽ��ʱij������Ũ��ռ������Ũ��֮�͵ķ�������pH�Ĺ�ϵ����ͼ��ʾ������˵������ȷ����
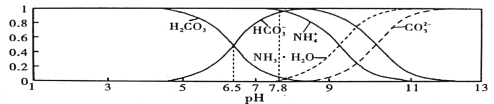
A. ������Kb(NH3��H2O)> Kal(H2CO3)
B. ��pH =6.5��������Һ����εμ�NaOH��Һʱ��NH4+��HCO3һŨ�ȶ���С
C. NH4HCO3��Һ�д��������غ��ϵ��c( NH4+) +c( NH3��H2O) =c(HCO3-)+c��CO3 2-��+c( H2 CO3)
D. ����Һ��pH =9ʱ����Һ�д������й�ϵ��c(HCO3-)>c(NH4+>c(NH3��H2O)>c��CO3 2-��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��RΪǰ������Ԫ�أ�ԭ��������������X��Yͬ���ڣ�X��̬ԭ�ӵ������������Ǵ�����2����Y��̬ԭ�ӵ�s�ܼ���p�ܼ��ϵ�������ȣ�Z�ǵؿ��к�����ߵĽ���Ԫ�أ�R+���ӵ�3d���ȫ��������ش��������⣺
��1��Z3+���ӵĺ�������Ų�ʽ��_______��
��2����ѧ�ҳɹ����ڸ�ѹ�½�XY2ת��Ϊ��������SiO2�ṹ��ԭ�Ӿ��壬�þ�����Xԭ�ӵ��ӻ����������_______��X��Z��R�ĵ��ʷֱ�������Y2��ַ�Ӧ���ò�����۵��ɸߵ��͵�˳����_______�����ѧʽ��
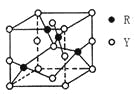
��3����Y��R�γɵ�ij������ľ����ṹ��ͼ��ʾ���仯ѧʽ��_______��
��4�������£�pH��ͬ��NaZY2��Na2XY3������Һ�����ʵ���Ũ�Ƚϴ����_______�����ѧʽ��
��5�����������Ƶ�ˮ��Һ��μ���RCl2��ˮ��Һ�У��ټ�������Ũ������ȣ��õ����ܵİ�ɫ����RCl���÷�Ӧ�����ӷ���ʽ��_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ��Ũ�Ⱦ�Ϊ0.1mol��L-1������ֱ�ΪVa��Vb��HA ��Һ��BOH��Һ����ͬ����Ȼ�ϣ�����Va+Vb=100mL��Va��Vb����Һ��pH�Ĺ�ϵ��ͼ��ʾ������˵����ȷ����
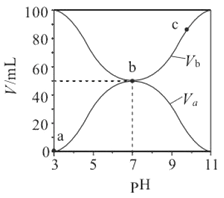
A. a��c ������ˮ�ĵ���̶�ʼ������
B. b��ʱ��c(B+)=c(A-)=c(H+)=c(OH-)
C. c��ʱ�� 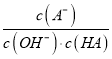 ���¶����߶���С
���¶����߶���С
D. ��ͬ�¶��£�Ka(HA)>Kb(BOH)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������п���㷺Ӧ����ҽҩ�����ũҵ��������ҵ��������п����Ҫ�ɷ�ΪZnO������ZnSiO3��FeCO3��CuO�ȣ�����ZnSO47H2O��һ��������ͼ��
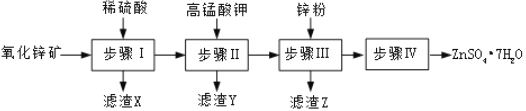
��1���������IJ�����____________��
��2������������ϡ����������ʱ���費��ͨ�����ˮ������Ŀ����______________��
��3���������У���pHԼΪ5.1����Һ�м��������أ�����Fe(OH)3��MnO(OH)2���ֳ������÷�Ӧ�����ӷ���ʽΪ____________________________________________��
��4���������У�����п�۵�������______________��
��5����֪����п���ܽ�����¶�֮��Ĺ�ϵ���±���
�¶�/�� | 0 | 20 | 40 | 60 | 80 | 100 |
�ܽ��/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
������п��Һ�л������п�����ʵ�����Ϊ________________����ȴ�ᾧ�����ˡ���ɲ������ڼ�ѹ���������½��У�ԭ����_________________________________��
��6��ȡ28.70 g ZnSO47H2O��������ͬ�¶ȣ�ʣ�����������仯��ͼ��ʾ���������ݣ�680��ʱ���ù���Ļ�ѧʽΪ______��
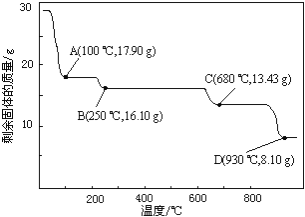
a��ZnO b��Zn3O(SO4)2 c��ZnSO4 d��ZnSO4H2O
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com