
(1)在25℃时,向浓度均为0.01 mol·L-1的MgCl2和AlCl3混合溶液中逐滴加入氨水,先生成________沉淀(填化学式),生成该沉淀的离子 方程式为_____________________。
方程式为_____________________。
(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,
Ksp[Al(OH)3]=3×10-34。)
(2)某温度(t℃)时,测得0.01 mol·L-1的NaOH溶液的pH=11。在此温度下,将pH=2的H2SO4溶液VaL与pH=12的NaOH溶液VbL混合,若所得混合液为中性,则Va︰Vb=________。
(3)在25℃时,将c mol·L-1的醋酸溶液与0.02 mol·L-1NaOH溶液等体积混合后溶液刚好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=________。
(4)(2013·山东高考)25℃时,H2SO3HSO +H+的电离常数Ka=1×10-2mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kb=________mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中
+H+的电离常数Ka=1×10-2mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kb=________mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中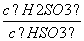 将________(填“增大”、“减小”或“不变”)。
将________(填“增大”、“减小”或“不变”)。
解析:(1)根据溶度积常数表达式可知,生成Mg(OH)2沉淀时需要的OH-浓度是 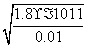 =4.2×10-5mol/L;同样可知生成氢氧化铝沉
=4.2×10-5mol/L;同样可知生成氢氧化铝沉 淀时需要的OH-浓度是
淀时需要的OH-浓度是 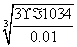 =3.1×10-11mol/L,所以首先生成的是氢氧化铝沉淀,反应的离子方程式是Al3++3NH3·H2O===Al(OH)3↓ +3NH
=3.1×10-11mol/L,所以首先生成的是氢氧化铝沉淀,反应的离子方程式是Al3++3NH3·H2O===Al(OH)3↓ +3NH 。
。
(2)0.01 mol·L-1的NaOH溶液的pH=11,所以溶液中氢离子浓度是1×10-11mol/L,而OH-浓度是0.01 mol/L,则该温度下水的离子积常数KW=10-13。pH=2的H2SO4溶液VaL与pH=12的NaOH溶液VaL混合,若所得混合液为中性,则Va×0.01=Vb×0.2,所以Va∶Vb=10∶1。
(3)c mol·L-1的醋酸溶液与0.02 mol·L-1NaOH溶液等体积 混合后溶液刚好呈中性,根据电荷守恒可知c(Na+)=c(CH3COO-)=0.01 mol/L,而溶液中氢离子浓度是1×10-7mol/L,根据物料守恒可知,溶液中醋酸的浓度是0.5 c-0.01,该温度下醋酸的电离常数 Ka=
混合后溶液刚好呈中性,根据电荷守恒可知c(Na+)=c(CH3COO-)=0.01 mol/L,而溶液中氢离子浓度是1×10-7mol/L,根据物料守恒可知,溶液中醋酸的浓度是0.5 c-0.01,该温度下醋酸的电离常数 Ka=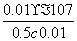 =2×10-9/(c-0.02)。
=2×10-9/(c-0.02)。
(4)Ka=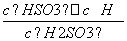 ,HSO
,HSO +H2OH2SO3+OH-,Kb=
+H2OH2SO3+OH-,Kb=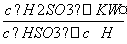 =
=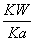 =
=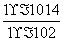 =1.0×10-12,当加入少量I2时,溶液酸性增强,c(H+)增大,但是温度不变,Kb不变,则
=1.0×10-12,当加入少量I2时,溶液酸性增强,c(H+)增大,但是温度不变,Kb不变,则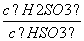 增大。
增大。
答案:(1)Al(OH)3 Al3++3NH3·H2O===Al(OH)3↓+3NH (2)10∶1
(2)10∶1
(3)2×10-9/(c-0.02) (4)1.0×10-12 增大


科目:高中化学 来源: 题型:
硅酸铜钡是当今用最新科学技术才能合成的一种物质。然而现在发现,我国秦朝兵马俑用的一种颜料竟是硅酸铜钡。下列关于硅酸铜钡的学说错误的是
A.易溶于水 B.难溶于水 C.属于硅酸盐 D.有颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积不变的密闭容器中进行反应:2SO2(g)+O2(g)2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是( )
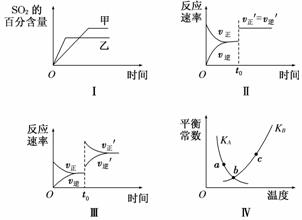
A.图Ⅰ表示温度对化学平衡的影响,且甲的温度较高
B.图Ⅱ表示t0时刻使用催化剂对反应速率的影响
C.图Ⅲ表示t0时刻增大O2的浓度对反应速率的影响
D.图Ⅳ中a、b、c三点中只有b点已经达到化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨工业的核心反应是:N2(g)+3H2(g)2NH3(g) ΔH=Q kJ·mol-1,能量变化如 下图,回答下列问题:
下图,回答下列问题:
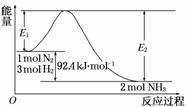
(1)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1________,E2________(填“增大”、“减小”或“不变”)。
(2)在500℃、2×107Pa和催化剂条件下向一密闭容器中充入0.5 mol N2和1.5 mol H2,充分反应后,放出的热量________ 46.2 kJ(填“<”、“>”或“=”)。
(3)关于该反应的下列说法中,正确的是________。
A.ΔH>0,ΔS>0 B.ΔH>0,ΔS<0
C.ΔH<0,ΔS>0 D.ΔH<0,ΔS<0
(4)将一定量的N2(g)和H2(g)放入1 L密闭容器中,在500℃、2×107Pa下达到平衡,测得N2为0.10 mol,H2为0.30 mol,NH3为0.10 mol。计算该条件下达到平衡时H2转化为NH3的转化率________。若升高温度,K值变化________(填“增大”、“减小”或“不变”)。
(5)在上述(4)反应条件的密闭容器中,欲提高合成氨中H2的转化率,下列措施可行的是________(填字母)。
A.向容器中按原比例再充入原料气
B.向容器中再充入惰性气体
C.改变反应的催化剂
D.分离出氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,取0.2 mol·L-1HX溶液与0.2 mol·L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH = 8,则下列说法(或关系式)正确的是( )
A.c(Na+)-c(X-)=9.9×10-7mol·L-1
B.c(Na+)=c(X-)+c(HX)=0.2 mol·L-1
C.c(OH-)-c(HX)=c(H+)=1×10-6mol·L-1
D.混合溶液中由水电离出的c(OH-)=10-8mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中能大量共存的是( )
A.pH=1的溶液中:Fe2+、NO 、SO
、SO 、Na+
、Na+
B.水电离出的c(H+)=10-12 mol/L的溶液中:Ca2+、K+、Cl-、HCO
C.c(H+)/c(OH-)=1012的水溶液中:NH 、Al3+、NO
、Al3+、NO 、Cl-
、Cl-
D.c(Fe3+)=0.1 mol/L的溶液中:K+、ClO-、SO 、SCN-
、SCN-
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
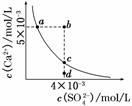
A.在任何溶液中,c(Ca2+)、c(SO )均相等
)均相等
B.b点将有沉淀生成,平衡后溶液中c(SO )一定等于3×10-3 mol/L
)一定等于3×10-3 mol/L
C.a点对应的Ksp等于c点对应的Ksp
D.d点溶液通过蒸发可以变到c点
查看答案和解析>>
科目:高中化学 来源: 题型:
为了提纯下表所列物质(括号内为杂质),有关除杂试剂和分离方法的选择均正确的是
( )
| 选项 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 己烷(己烯) | 溴水 | 分液 |
| B | 淀粉溶液(NaCl) | 水 | 过滤 |
| C | CH3CH2OH (CH3COOH) | CaO | 蒸馏 |
| D | CO2(SO2) | Na2CO3溶液 | 洗气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,向20.00 mL 0.100 mol·L-1CH3COONa溶液中逐滴加入0.100 mol·L-1盐酸,溶液的pH与所加入盐酸体积的关系如图所示(不考虑挥发)。下列说法正确的是( )
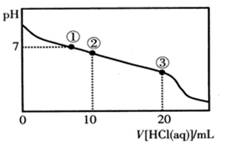
A.点①所示溶液中:c(Na+)=c(Cl-)>c(H+)=c(OH-)
B.点②所示溶液中:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH)
C.点③所示溶液中:c(Na+)>c(CH3COOH)>c (H+)>c(CH3COO-)
D.整个过程中可能出现:c(H+)+c(Na+)=c(CH3COO-)+c(CH3COOH)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com