
【题目】亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,使用过量会使人中毒,国际上对食品中亚硝酸钠的用量控制在很低的水平上。某学习小组针对亚硝酸钠设计了如下实验:
(实验Ⅰ)制备NaNO2
该小组查阅资料知:2NO+Na2O2=2NaNO2;2NO2+Na2O2=2NaNO3。
制备装置如图所示(夹持装置略去):
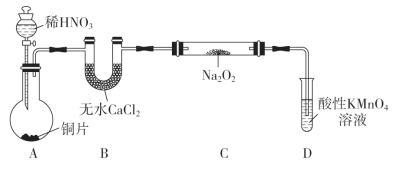
(1)装置D可将剩余的NO氧化成NO3-,发生反应的离子方程式为____________。
(2)如果没有B装置,C中发生的副反应有_____________、____________。
(3)甲同学检查完装置气密性良好后进行实验,发现制得的NaNO2中混有较多的NaNO3杂质。于是进行了适当的改进,改进后提高了NaNO2的纯度,则其改进措施是________________________________。
(实验Ⅱ)测定制取的样品中NaNO2的含量
步骤:
a.在5个有编号的带刻度试管(比色管)中分别加入不同量的NaNO2溶液,各加入1 mL的M溶液(M遇NaNO2呈紫红色,NaNO2浓度越大颜色越深),再加蒸馏水至总体积均为10 mL并振荡,制成标准色阶:
试管编号 | ① | ② | ③ | ④ | ⑤ |
NaNO2含量/(mg·L-1) | 0 | 20 | 40 | 60 | 80 |
b.称量0.10 g制得的样品,溶于水配成500 mL溶液。取5 mL待测液,加入1 mL M溶液,再加蒸馏水至10 mL并振荡,与标准色阶比较。
(4)步骤b中比较结果是:待测液颜色与③标准色阶相同,则甲同学制得的样品中NaNO2的质量分数是________。
(5)用目视比色法证明维生素C可以有效降低NaNO2的含量。设计并完成下列实验报告。
实验方案 | 实验现象 | 实验结论 |
取5 mL待测液,加入______________,振荡,再加入1 mL M溶液,_______________,再振荡,与③标准色阶对比 | _______________ | 维生素C可以有效降低NaNO2的含量 |
【答案】5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O 2Na2O2+2H2O=4NaOH+O2↑ 2NO+O2=2NO2 2NO2+Na2O2=2NaNO3 在A、B之间增加装有水的洗气瓶 40% 维生素C 加入蒸馏水至总体积为10 mL 紫红色比③标准色阶浅
【解析】
装置A是铜与稀硝酸发生生成NO,无水CaCl2的作用是干燥NO,装置C为NO与Na2O2反应,氮的氧化物有毒,对环境有危害,需要尾气处理,装置D的作用是吸收氮的氧化物;
(1)NO能被酸性高锰酸钾溶液发生氧化反应,NO被氧化成NO3-,MnO4-被还原成Mn2+,书写出离子方程式;
(2)B装置作用是干燥NO,如果去掉B装置,NO中含有水蒸气,水蒸气能与Na2O2发生反应,据此分析;
(3)装置中含有氧气,产生NO能与O2反应生成NO2,根据信息,NO2能与Na2O2反应生成NaNO3,改进装置,除去氧气或将NO2转化成NO,据此分析;
(4)根据表中数据,与③标准色阶相同,此时溶液中NaNO2含量为40mg·L-1,然后计算质量分数即可;
(5) 操作需要与a步骤进行;
(1)酸性KMnO4溶液具有强氧化性,能将NO氧化为NO![]() ,反应的离子方程式为5NO+3MnO4-+4H+===5NO3-+3Mn2++2H2O;
,反应的离子方程式为5NO+3MnO4-+4H+===5NO3-+3Mn2++2H2O;
(2)铜和稀硝酸反应制得的NO中含有杂质水蒸气,去掉装置B,水蒸气与Na2O2反应:2Na2O2+2H2O=4NaOH+O2↑,NO与O2反应:2NO+O2=2NO2,NO2与Na2O2反应:2NO2+Na2O2=2NaNO3;
(3)制得的NaNO2中混有较多的NaNO3杂质,说明制得的NO中混有NO2,应在装置A、B之间增加装有水的洗气瓶,以除去杂质NO2;
(4)待测液颜色与③标准色阶相同,则甲同学制得的样品中NaNO2的质量是40 mg·L-1 ×0.01 L×![]() =40 mg=0.04 g,故样品中NaNO2的质量分数=
=40 mg=0.04 g,故样品中NaNO2的质量分数=![]() ×100%=40%;
×100%=40%;
(5)取5 mL待测液,然后加入维生素C,再加入1 mL M溶液,最后加入蒸馏水至总体积为10 mL,若紫红色比③标准色阶浅,说明NaNO2的含量低,则可以证明维生素C可以有效降低NaNO2的含量。


科目:高中化学 来源: 题型:
【题目】无色气体N2O4是一种强氧化剂,为重要的火箭推进剂之一。N2O4与NO2转换的热化学方程式为N2O4(g)![]() 2NO2(g) ΔH=+24.4 kJ/ mol。
2NO2(g) ΔH=+24.4 kJ/ mol。
(1)将一定量N2O4投入固定容积的真空容器中,下述现象能说明反应达到平衡的是____
a v正(N2O4)=2v逆(NO2) b 体系颜色不变
c 气体平均相对分子质量不变 d 气体密度不变
(2)平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数[例如:p(NO2)=p总×x(NO2)]。写出上述反应平衡常数Kp表达式_________(用p总、各气体物质的量分数用x表示);
(3)上述反应中,正反应速率v正=k正·p(N2O4),逆反应速率v逆=k逆·p2(NO2),其中k正、k逆为速率常数,则Kp为_______(以k正、k逆表示)。若将一定量N2O4投入真空容器中恒温恒压分解(温度298K、压强100kPa),已知该条件下k正=4.8×104s-1,当N2O4分解10%时,v正=_______kPa·s-1。(结果保留两位有效数字)
(4)真空密闭容器中放入一定量N2O4,维持总压强p0恒定,在温度为T时,平衡时N2O4分解百分率为α。保持温度不变,向密闭容器中充入等量N2O4,维持总压强在2p0条件下分解,则N2O4的平衡分解率的表达式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用含有铁锈(Fe2O3)的废铁屑来制取氯化铁晶体的装置(省略夹持装置,气密性已检查)如图所示。下列推断不合理的是( )
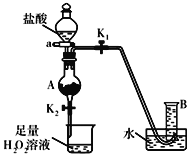
A.烧杯中H2O2溶液作用是将Fe2+氧化为Fe3+
B.A中存在氧化铁与盐酸反应生成氯化铁的反应
C.B中收集到的气体是氢气
D.反应后的烧杯中通入少量SO2,则溶液颜色立即由棕黄色变为浅绿色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实一定能说明HF是弱酸的是( )
①常温下NaF溶液的pH大于7; ②用HF溶液做导电性实验,灯泡很暗;
③HF与NaCl不能发生反应; ④常温下0.1mol/L的HF溶液的pH为2.3
⑤HF能与Na2CO3溶液反应,产生CO2气体 ⑥HF与水能以任意比混溶
⑦1mol/L的HF水溶液能使紫色石蕊试液变红
A. ①④ B. ②③⑤ C. ③④⑥ D. ①②⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如右图所示,下列说法中,正确的是
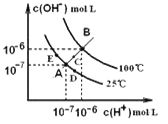
A. 图中A、B、D三点处KW间的关系: B>A>D
B. 100℃,向pH=2的稀硫酸中逐滴加入等体积pH=10的稀氨水,溶液中 c(NH4+)/c(NH3·H2O)减小,充分反应后,溶液到达B点
C. 温度不变,在水中加入适量NH4Cl固体,可从A点变化到C点
D. 加热浓缩A点所示溶液,可从A点变化到B点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向一定体积0.1mol·L-1的氨水中逐渐加入等浓度的盐酸,溶液中pOH [pOH=-lgc(OH-)]与pH的变化关系如下图所示.下列说法不正确是
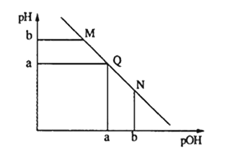
A. M点和N点溶液中H2O的电离程度相同
B. Q点溶液中,c(NH4+)+c(NH3·H2O)=c(Cl-)
C. M点溶液的导电性小于Q点溶液的导电性
D. N点溶液加水稀释,![]() 变小
变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是以煤炭为主要能源的发展中国家,煤炭燃烧产生的烟气中含有大量的NOx和SO2,带来了严重的大气污染。某化工小组进行了ClO2协同氨水法脱除模拟烟气中NOx和SO2的实验研究,其流程如图:
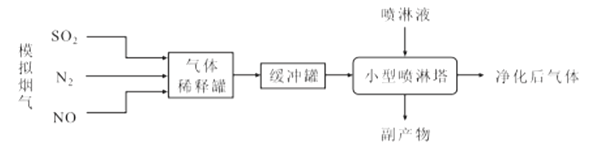
回答下列问题:
(1)制备“模拟烟气”时应首先向装置管道内通入__,目的是__。
(2)“喷淋液”中所含ClO2可通过向酸性氯酸钠溶液中加入葡萄糖的方法制备,同时产生CO2等物质,则该反应的离子方程式为__,还可将葡萄糖替换为__(填字母标号)。
A.FeCl3溶液 B.SO3 C.甲醇 D.酸性KMnO4溶液
(3)利用ClO2协同氨水进行脱硫脱硝净化时,污染性气体脱除效率变化情况如图所示,则该脱除技术的最佳温度应为__℃,喷淋塔中可能产生的一种副产物的化学式为__,该物质的常见用途是__。

(4)传统湿式氨法烟气处理技术以尿素[CO(NH2)2]热水解产生的NH3溶于水为喷淋液。在催化剂作用下,喷淋除去NO过程中有一种无污染气体生成,该反应的化学方程式为__。
(5)该化工小组设定模拟烟气流量am3/h,进口NO质量浓度bmg/m3,吸收液循环量cL/h,通过离子色谱测定脱除前后吸收液中主要离子浓度如下表所示,则NO的脱除率为__(用含有a、b、c的代数式表示)。
离子种类 浓度数据 | ClO2 (mg/L) | Cl- (mg/L) | SO42- (mg/L) | SO32- (mg/L) | NO3- (mg/L) | NO2- (mg/L) |
吸收前 | 150 | 43.54 | —— | —— | —— | —— |
吸收后 | 12.62 | 110.49 | 213.64 | —— | 62.00 | —— |
反应前后差值 | 137.38 | 66.95 | 213.64 | —— | 62.00 | —— |
注:“——”表示该离子低于检测极限,可以认为不存在。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以TiO2为催化剂的光热化学循环分解CO2反应为温室气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如下图所示。
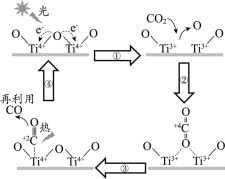
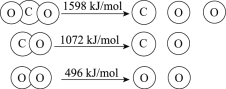
下列说法正确的是
A.过程①中钛氧键断裂会释放能量
B.该反应中,光能和热能转化为化学能
C.使用TiO2作催化剂可以降低反应的焓变,从而提高化学反应速率
D.CO2分解反应的热化学方程式为2CO2(g) =2CO(g) + O2(g) ΔH= + 30 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由SO2和O2制备SO3(熔点16.8℃,沸点44.8℃)的模拟装置如下图所示)(加热和夹持装置省略):

下列说法正确的是
A. 装置①中的试剂为饱和NaHSO3溶液
B. 实验室可用铜与稀硫酸在加热条件下制取SO2
C. 裝置③反应管中的铂石棉用作反应的催化剂
D. 从装置⑤逸出的气体有过量的SO2和O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com