
【题目】中国科学院科研团队研究发现,在常温常压和可见光下,基于 LDH(一种固体催化剂)合成NH3的原理示意图如图所示。下列说法不正确的是( )
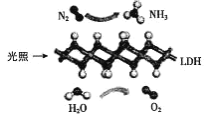
A.该反应属于置换反应
B.该过程中只涉及极性键的断裂与生成
C.基于 LDH 合成 NH3的过程属于氮的固定
D.该过程中每生成 2.24L(标准状况)O2则转移 0.4mol 电子
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g)![]() 4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是
4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是
A.前2 min,D的平均反应速率为0.2 mol·L-1·min-1
B.此时,B的平衡转化率是40%
C.增大该体系的压强,平衡不移动
D.增加B,平衡向右移动,B的平衡转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知0.1 mol·L-1的氢氟酸溶液中存在电离平衡:HF![]() F-+H+,要使溶液中
F-+H+,要使溶液中![]() 的值增大,可以采取的措施是( )
的值增大,可以采取的措施是( )
①加少量烧碱溶液 ②升高温度 ③通入少量HF气体 ④加水
A.①②B.①③C.②④D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应xM (g)+yN(g)![]() zP(g)。平衡时测得M的浓度为0.80 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得M的浓度降低为0.50 mol/L。下列有关判断正确的是
zP(g)。平衡时测得M的浓度为0.80 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得M的浓度降低为0.50 mol/L。下列有关判断正确的是
A.x + y < zB.平衡向正反应方向移动
C.N的转化率降低D.混合气体的密度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,已知:四种原了最外层电子数之和为24。下列说法止确的是
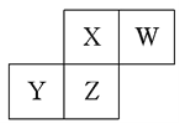
A. 元索Ⅹ和元Z的最高正化合价相同
B. 单核阴离子半径的大小顺序为:r(W)>r(X)
C. 气态简单氢化物的热稳定性顺序为:Y<Z<X<W
D. 元素Z的氧化物对应水化物都是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示。请回答:
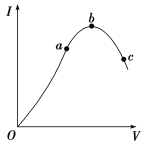
(1)“O”点导电能力为0的理由是_________________________。
(2)写出醋酸的电离方程式___________________________________________。
(3)a、b、c三点溶液中氢离子浓度由小到大的顺序为__________________ 。
(4)a、b、c三点处,电离程度最大的是________。
(5)醋酸与氨水反应的离子方程式:__________________ 。
(6)写出醋酸电离平衡常数表达式:_______________;
(7)向0.1mol/L 醋酸溶液中加入水,电离平衡向_______移动 (填“左”或“右”) ;n(CH3COOH)_______; c(CH3COO-)/c(CH3COOH)_______(填“增大”、“减小”或“不变”);
(8)500mL 0.1mol/L 醋酸溶液a和500mL 0.1mol/L 盐酸溶液b与足量Zn粉反应,初始速率a___b;生成H2的量a____b;完全中和这两种酸,消耗NaOH的量a___b(填“<”、“>”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式为![]() 。下列有关说法错误的是
。下列有关说法错误的是
A. 该有机物的分子式为C10H10O2
B. 该有机物能发生加成反应、取代反应、氧化反应
C. 该有机物分子中所有碳原子可能共平面
D. 该有机物能使酸性高锰酸钾溶液和溴水褪色,其褪色原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甘氨酸亚铁[(NH2CH2COO)2Fe]是一种补铁强化剂。实验室利用FeCO3与甘氨酸(NH2CH2COOH)制备甘氨酸亚铁,实验装置如下图所示(夹持和加热仪器已省略)。
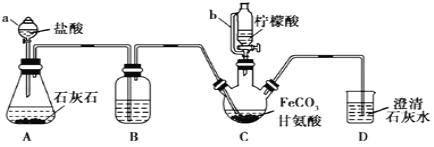
查阅资料已知:①甘氨酸易溶于水,微溶于乙醇;甘氨酸亚铁易溶于水,难溶于乙醇。
②柠檬酸易溶于水和乙醇,具有较强的还原性和酸性。实验过程如下:
I.装置C中盛有17.4gFeCO3和200mL1.0mol·L-1甘氨酸溶液。实验时,先打开仪器a的活塞,待装置c中空气排净后,加热并不断搅拌;然后向三颈瓶中滴加柠檬酸溶液。
Ⅱ.反应结束后过滤,将滤液进行蒸发浓缩;加入无水乙醇,过滤、洗涤并干燥。
(1)仪器a的名称是_________;与a相比,仪器b的优点是_________。
(2)装置B中盛有的试剂是:________;
(3)向FeSO4溶液中加入NH4HCO3溶液可制得FeCO3,该反应的离子方程式为_____。
(4)过程I加入柠檬酸促进FeCO3溶解并调节溶液pH,柠檬酸的作用还有________。
(5)过程II中加入无水乙醇的目的是_________。
(6)本实验制得15.3g甘氨酸亚铁,则其产率是________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铁是常见的水处理剂,利用废铁屑可制备无水氯化铁。实验室制备装置和工业制备流程图如下:
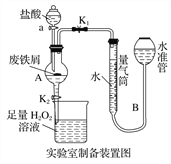
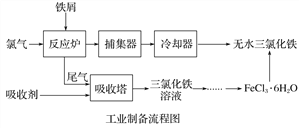
已知:(1)无水FeCl3的熔点为555 K、沸点为588 K。
(2)废铁屑中的杂质不与盐酸反应。
(3)不同温度下六水合氯化铁在水中的溶解度如下:
温度/℃ | 0 | 20 | 80 | 100 |
溶解度(g/100 g H2O) | 74.4 | 91.8 | 525.8 | 535.7 |
实验室制备操作步骤如下:
Ⅰ.打开弹簧夹K1,关闭活塞K2,并打开活塞a,缓慢滴加盐酸;
Ⅱ.当……时,关闭弹簧夹K1,打开活塞K2,当A中溶液完全进入烧杯后关闭活塞a;
Ⅲ.将烧杯中溶液经过一系列操作后得到FeCl3·6H2O晶体。
请回答:
(1)烧杯中足量的H2O2溶液的作用是_____________________________。
(2)为了测定废铁屑中铁的质量分数,操作Ⅱ中“…”的内容是______________。
(3)从FeCl3溶液制得FeCl3·6H2O晶体的操作步骤是加入______________后__________________、过滤、洗涤、干燥。
(4)试写出吸收塔中反应的离子方程式:______________________。
(5)捕集器温度超过673 K时,存在相对分子质量为325的铁的氯化物,该物质的分子式(相对原子质量:Cl-35.5、Fe-56)为____________。
(6)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,配制成100 mL溶液;取出10.00 mL,加入稍过量的KI溶液,充分反应后,滴入几滴淀粉溶液,并用c mol·L-1 Na2S2O3溶液滴定,消耗V mL(已知:I2+2S2O32-=2I-+S4O62-)。
①滴定终点的现象是________________________________________________;
②样品中氯化铁的质量分数为__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com