
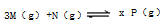 ��ע��xΪP����
��ע��xΪP����| A�����ٴ�ƽ��ʱ�����������и�����l mol M��N��P����N��ת����һ������ |
| B�������ƽ�����ټ���3mol M��2 mol N��P���������������a�����ж�x>4 |
| C����x=2�������ϵ��ʼ���ʵ���Ӧ������3 n��N��=n��M�� |
| D��������ϵ��ʼ���ʵ�������3 n��P��+8 n��M��="12" n��N�������ж�x=4 |


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2SO3(g)��
2SO3(g)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
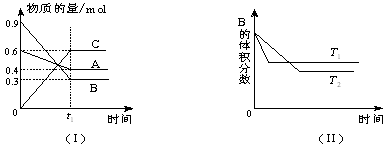
 2HI(g)�����������˵���÷�Ӧһ���ﵽƽ��״̬����
2HI(g)�����������˵���÷�Ӧһ���ﵽƽ��״̬����| A������������ɫ���ٸı� |
| B����������ѹǿ���ٸı� |
| C����λʱ���ڲ�1mol H��H����ͬʱ����2mol H��I�� |
| D�����������ܶȲ��ٸı� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
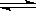 x Q(g) +3R(g)���÷�Ӧ��ƽ��ʱ������2.4mol R�������Q��Ũ��Ϊ0.4 mol/L�������й�������ȷ����
x Q(g) +3R(g)���÷�Ӧ��ƽ��ʱ������2.4mol R�������Q��Ũ��Ϊ0.4 mol/L�������й�������ȷ����| A��xֵΪ2 | B�����������ܶ����� |
| C��ƽ��ʱN��Ũ��Ϊ0.2 mol/L | D��N��ת����Ϊ80% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
 x C��g��+ 2D��g������5s��Ӧ��ƽ�⡣�ڴ�5s��C��ƽ����Ӧ����Ϊ0.
x C��g��+ 2D��g������5s��Ӧ��ƽ�⡣�ڴ�5s��C��ƽ����Ӧ����Ϊ0. 2 m
2 m ol��L-1��s-1��ͬʱ����1 mol D������
ol��L-1��s-1��ͬʱ����1 mol D�������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 z C
z C 2Z(g)+W(g)����H��0���ﵽƽ��ʱ��V��A��=" 1.2a" L��
2Z(g)+W(g)����H��0���ﵽƽ��ʱ��V��A��=" 1.2a" L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
 2SO3(g) ��֪c(SO2)ʼ=0.4mol/L��c(O2)ʼ=1mol/L���ⶨ�÷�Ӧ�ڸ��¶��µ�ƽ�ⳣ��K��19�����жϣ�
2SO3(g) ��֪c(SO2)ʼ=0.4mol/L��c(O2)ʼ=1mol/L���ⶨ�÷�Ӧ�ڸ��¶��µ�ƽ�ⳣ��K��19�����жϣ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
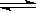 2CO(g)ƽ�ⳣ��K�ı���ʽΪ ��
2CO(g)ƽ�ⳣ��K�ı���ʽΪ ��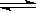 CO(g)+H2(g)��ƽ�ⳣ��ΪK1��H2(g)��CO2(g)
CO(g)+H2(g)��ƽ�ⳣ��ΪK1��H2(g)��CO2(g) 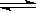 CO(g)��H2O(g)��ƽ�ⳣ��ΪK2 ����K��K1��K2���ߵĹ�ϵΪ ��
CO(g)��H2O(g)��ƽ�ⳣ��ΪK2 ����K��K1��K2���ߵĹ�ϵΪ �� 2SO3����ƽ�ⳣ��K=19
2SO3����ƽ�ⳣ��K=19 ��1������Ӧ�ڸ��¶���SO2ת����Ϊ80��ʱ���÷�Ӧ (��ǡ���)�ﵽ��ѧƽ��״̬����δ�ﵽ���� (�����Ӧ�����淴Ӧ��) ������С�
��1������Ӧ�ڸ��¶���SO2ת����Ϊ80��ʱ���÷�Ӧ (��ǡ���)�ﵽ��ѧƽ��״̬����δ�ﵽ���� (�����Ӧ�����淴Ӧ��) ������С� cC(g)+dD(g) ��H = a kJ��mol-1��
cC(g)+dD(g) ��H = a kJ��mol-1���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com