
| 主要成分:25% NaClO、1000mL、密度1.198g•cm-3 使用方法:稀释100倍(体积比)后使用 注意事项:密封保存,易吸收空气中CO2的变质 |
| A. | 该“84消毒液”的浓度为4.0mol•L-1 | |
| B. | 一瓶该“84消毒液”可能吸收CO2 44.8L(标况) | |
| C. | 稀释后的“84消毒液”中c(Na+)约为0.04 mol•L-1 | |
| D. | 若用NaClO 固体配制480mL含25%NaClO“84消毒液”,需要称量NaClO固体143g |
分析 根据c=$\frac{1000ρω}{M}$计算84消毒液的c(NaClO),以此可知c(Na+),以及配制一定体积所需NaClO的质量,与CO2发生反应可生成碳酸钠或碳酸氢钠,以此解答该题.
解答 解:A.c=$\frac{1000ρω}{M}$=$\frac{1000×1.198g/L×25%}{74.5g/mol}$≈4.0mol•L-1 ,故A正确;
B.一瓶该“84消毒液”含有NaClO的物质的量为1L×4.0mol/L=4mol,如与二氧化碳反应生成碳酸钠,则需要2molCO2,标况下体积为2mol×22.4L/mol=44.8L,故B正确;
C.稀释100倍,浓度为原来的$\frac{1}{100}$.考虑浓度变化,c(Na+)约为0.04 mol•L-1,故C正确;
D.实验室不存在480mL容量瓶,应用500mL容量瓶配制,则n(NaClO)=0.5L×4.0mol/L=2.0mol,m(NaClO)=2.0mol×74.5g/mol=149g,故D错误.
故选D.
点评 本题考查物质的量浓度的计算,侧重于学生的分析、计算能力的考查,注意把握相关计算公式的运用,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L己烷中的分子数约为NA个 | |
| B. | 常温常压下,在18 g H218O中含有NA个水分子 | |
| C. | 标准状况下,15 g CH3CH3所含共价键数为3.5NA个 | |
| D. | 电解精炼铜时,若电路中转移的电子数为2NA个,则阳极质量减轻64 g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 有关元素X、Y、Z、D、E的信息如表
有关元素X、Y、Z、D、E的信息如表| 元素 | 有关信息 |
| X | 元素主要化合价为-2,原子半径为0.074nm |
| Y | 所在主族序数与所在周期序数之差为4 |
| Z | 原子半径为0.102nm,其单质在X的单质中燃烧,发出明亮的蓝紫色火焰 |
| D | 最高价氧化物既能溶于强酸又能溶于强碱 |
| E | 单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏 |
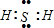
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池在放电时,Ag电极是电池的负极 | |
| B. | 充电时阳极发生的电极反应是:2Ag+2OH--2e-═Ag2O+H2O | |
| C. | 该电池可用酸作电解质溶液 | |
| D. | 充电时电流从Zn电极经电解质溶液流向外接电源的正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量洗气瓶B中溶液于试管A中,滴加过量2 mol/LHCl和1 mol/LBaCl2溶液,振荡. | 若产生的白色沉淀,则洗气瓶B溶液中存在SO42-. |
| 步骤2:另取适量洗气瓶B中溶液于试管B中,滴加过量l mol/LBa(NO3)2溶液,振荡,静置. | 产生白色沉淀. |
| 步骤3:取步骤2后试管B中的上层清液于试管C中,滴加0.1mol/LAgNO3溶液和过量的2mol/LHNO3,振荡. | 若产生白色沉淀,则洗气瓶B溶液中存在Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
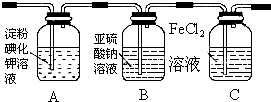
| 氯化铁溶液用量 | 10滴 | 20滴 | 30滴 | 2mL | 3mL | 4mL |
| 萃取后上层溶液颜色 | 黄色 | 黄色 | 黄色 | 较深黄色 | 黄色略带红色 | 黄红色 |
| 加入KSCN溶液后颜色 | 不变红 | 不变红 | 略变红 | 偏血红色 | 血红色 | 血红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 分子式 | 中心原子杂化方式 | 价层电子对互斥模型 | 分子或离子立体构型 |
| A | SO2 | sp | 直线形 | 直线形 |
| B | HCHO | sp2 | 平面三角形 | 三角锥形 |
| C | NF3 | sp2 | 四面体形 | 平面三角形 |
| D | NH4+ | sp2 | 正四面体形 | 正四面体形 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A | B | C | D |
 | 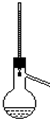 | 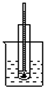 |  |
| A. | 酒精和浓硫酸混合加热制乙烯 | B. | 石油分馏实验 | ||
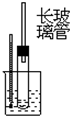
| C. | 苯跟溴的取代反应 | D. | 电石跟水反应制乙炔 |
查看答案和解析>>
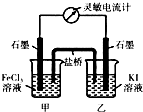
科目:高中化学 来源: 题型:选择题
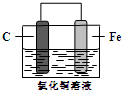
| A. | 碳棒为正极 | |
| B. | 碳棒上的电极反应式为2H2O+O2+4e-═4OH- | |
| C. | 铁片上的电极反应式为2Cl--2e-═Cl2↑ | |
| D. | 铁片为阴极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com