
| 转化率(%) | 0.1MPa | 0.5MPa | 1.0MPa | 10MPa |
| 400℃ | 99.2% | 99.6% | 99.7% | 99.9% |
| 500℃ | 93.5% | 96.9% | 97.8% | 99.3% |
| 600℃ | 73.7% | 85.8% | 89.5% | 96.4% |
分析 (1)二氧化硫与氧气反应生成三氧化硫,反应可逆;相同压强下,随温度升高二氧化硫的转化率降低,说明升温平衡逆向移动;
(2)在其他条件不变的情况下,扩大容器体积,各组分浓度减小,平衡向气体体积增大的方向移动;
(3)据v(SO2)=$\frac{\frac{△n}{V}}{△t}$求算二氧化硫的反应速率,则v(O2)=$\frac{1}{2}$v(SO2),增大氧气浓度平衡正向移动,二氧化硫转化率增大;
(4)由表中数据可知,增大压强对SO2的转化率影响不大,同时增大成本.
解答 解:(1)二氧化硫与氧气反应生成三氧化硫,反应可逆,化学方程式为2SO2+O2?2SO3;相同压强下,随温度升高二氧化硫的转化率降低,说明升温平衡逆向移动,正反应放热,故答案为:2SO2+O2?2SO3;放热;
(2)扩大容器体积,各组分浓度减小,正逆反应速率都减小,平衡向气体体积增大的逆向移动,故答案为:减小;减小;逆反应;
(3)v(O2)=$\frac{1}{2}$v(SO2)=$\frac{1}{2}$×$\frac{\frac{△n}{V}}{△t}$=$\frac{1}{2}×\frac{\frac{0.20mol-0.16mol}{2L}}{10s}$=0.001mol/(L•s),增大氧气浓度平衡正向移动,二氧化硫转化率增大,故答案为:0.001;增大;
(4)由表中数据可知,增大压强对SO2的转化率影响不大,同时增大成本,故通常采取采用常压而不是高压,故答案为:常压时的转化率较高、高压成本高.
点评 本题考查硫酸工业、影响化学反应速率的因素、化学反应速率的计算等,题目难度不大.


科目:高中化学 来源: 题型:解答题
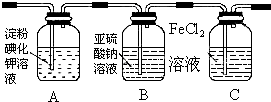
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量洗气瓶B中溶液于试管A中,滴加过量2 mol/LHCl和1 mol/LBaCl2溶液,振荡. | 若产生的白色沉淀,则洗气瓶B溶液中存在SO42-. |
| 步骤2:另取适量洗气瓶B中溶液于试管B中,滴加过量l mol/LBa(NO3)2溶液,振荡,静置. | 产生白色沉淀. |
| 步骤3:取步骤2后试管B中的上层清液于试管C中,滴加0.1mol/LAgNO3溶液和过量的2mol/LHNO3,振荡. | 若产生白色沉淀,则洗气瓶B溶液中存在Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HAt很稳定 | B. | At是有色固体 | ||
| C. | At易溶于有机溶剂 | D. | AgAt不溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| 氢气体积/mL | 0 | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 碳棒为正极 | |
| B. | 碳棒上的电极反应式为2H2O+O2+4e-═4OH- | |
| C. | 铁片上的电极反应式为2Cl--2e-═Cl2↑ | |
| D. | 铁片为阴极 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 非金属原子间不可能形成离子键 | B. | 只有不同的原子间才能形成共价键 | ||
| C. | 共价化合物中不可能含离子键 | D. | 离子化合物中可能含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可逆反应达到化学平衡状态时,正、逆反应速率均等于零 | |
| B. | 当反应物与生成物浓度相等时,可逆反应一定已达到化学平衡状态 | |
| C. | 用锌粉代替锌粒与等浓度的稀硫酸反应,生成氢气的速率加快 | |
| D. | Fe与稀硫酸反应制取氢气时,改用浓硫酸可以增大反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01molMg在空气中完全燃烧生成MgO和Mg3N2,转移电子数目为0.02NA | |
| B. | 常温常压下,18.00克重水(D2O)中所含电子数约为10NA | |
| C. | 在熔融状态下1molNaHSO4所含阳离子数为2NA | |
| D. | 1mol FeCl3完全水解转化为氢氧化铁胶体后能生成NA个胶粒 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com