



科目:高中化学 来源: 题型:
 某学习小组为探究盐酸、碳酸、硅酸酸性强弱,并证明醋酸为弱酸,进行如下实验:
某学习小组为探究盐酸、碳酸、硅酸酸性强弱,并证明醋酸为弱酸,进行如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
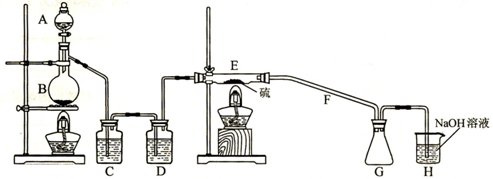
某学习小组为探究S和Cl2能否反应,经查资料获得信息,干燥的Cl2在110℃~140℃与S反应,可得S2Cl2粗品,由此设计如下试验装置(夹持装置未画出),请回答后面问题。

(1)实验过程中,使用分液漏斗滴加浓盐酸的操作是
(2)用反应方程式表示H装置的作用
(3)写出B中反应的离子方程式
(4)C、D中的试剂分别是 ,
(5)经检测粗品中含有SCl2,为减少SCl2的生成,关键的操作是
(6)F导管可能会发生堵塞,请在C、D之间设计一个防堵塞装置以免发生危险。(要求画出装置图,标出试剂名称,夹持装置不需画出)
查看答案和解析>>
科目:高中化学 来源: 题型:
(08茂名市二模)(本题12分)某学习小组为探究S和Cl2能否反应,经查资料获得信息,干燥的Cl2在110℃~140℃与S反应,可得S2Cl2粗品,由此设计如下试验装置(夹持装置未画出),请回答后面问题。

(1)实验过程中,使用分液漏斗滴加浓盐酸的操作是 (2分)(2)用反应方程式表示H装置的作用 (2分)(3)写出B中反应的离子方程式 (2分)(4)C、D中的试剂分别是 , (2分)(5)经检测粗品中含有SCl2,为减少SCl2的生成,关键的操作是 (2分)(6)F导管可能会发生堵塞,请在C、D之间设计一个防堵塞装置以免发生危险。(要求画出装置图,标出试剂名称,夹持装置不需画出) (2分)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com