
现有常温下的四份溶液:①0.01 mol/L CH3COOH溶液;②0.0l mol/L HC1溶液;③pH=12的氨水;④pH=12的NaOH溶液。下列说法正确的是
A.①中水的电离程度最小,③中水的电离程度最大
B.将②、③混合,若pH=7,则消耗溶液的体积:②>③
C.将①、④混合,若c(CH3COO-)>c(H+),则混合液一定呈碱性
D.将四份溶液分别稀释100倍后,溶液的pH:③>④,①<②
B
【解析】
试题分析:A、①②③④相比,①中的氢离子浓度最小,对水的电离影响最弱,所以①中水的电离程度最大,错误;B、pH=12的氨水中一水合氨的浓度大于0.01mol/L,所以等体积的②③混合,溶液会显碱性,所以要使溶液呈中性,碱应小于酸的体积,即②>③,正确;C、①④的物质浓度相等,二者混合,所得溶液若为醋酸和醋酸钠的溶液时,有c(CH3COO-)>c(H+)成立,但此时溶液为酸性,错误;D、对于③④,pH相同,稀释相同的倍数后,由于一水合氨是弱碱会促进其电离,所以氨水的碱性强于氢氧化钠;对于①②,二者的物质的量浓度相同,②中的氢离子浓度远远大于①,所以稀释相同的倍数后,尽管会促进①中的醋酸分子的电离,但氢离子浓度仍会小于②,所以①②相比,②的pH小于①,酸性更强,所以错误,答案选B。
考点:考查强、弱电解质溶液中的离子浓度与物质的量浓度的关系,稀释后的溶液pH变化,溶液酸碱性的判断


科目:高中化学 来源:2013-2014学年辽宁省东北三省高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
氯化铁和高铁酸钾都是常见的水处理剂。下图为制备氯化铁及进一步氧化制备高铁酸钾的工艺流程。
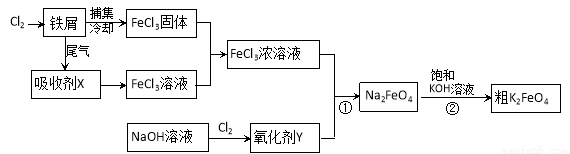
请回答下列问题:
(1)氯化铁有多种用途,请用离子方程式表示下列用途的原理。
①氯化铁做净水剂______________________;
②用FeCl3溶液(32%~35%)腐蚀铜印刷线路板____________________________。
(2)吸收剂X的化学式为 ;氧化剂Y的化学式为________________。
(3)碱性条件下反应①的离子方程式为____________________________________。
(4)过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品。该反应的化学方程式为
2KOH+Na2FeO4=K2FeO4+2NaOH,请根据复分解反应原理分析反应发生的原因_________。
(5)K2FeO4 在水溶液中易发生反应:4FeO42?+10H2O 4Fe(OH)3+8OH?+3O2↑。在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 (填序号)。
4Fe(OH)3+8OH?+3O2↑。在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 (填序号)。
A.H2O B.稀KOH溶液、异丙醇 C.NH4Cl溶液、异丙醇 D.Fe(NO3)3溶液、异丙醇
(6)可用滴定分析法测定粗K2FeO4的纯度,有关反应离子方程式为:
①FeO42?+CrO2? +2H2O CrO42?+Fe(OH)3↓+OH?
CrO42?+Fe(OH)3↓+OH?
②2CrO42?+2H+ Cr2O72?+H2O
Cr2O72?+H2O
③Cr2O72 ?+6Fe2++14H+ 2Cr3++6Fe3++7H2O
2Cr3++6Fe3++7H2O
现称取1.980 g粗高铁酸钾样品溶于适量氢氧化钾溶液中,加入稍过量的KCrO2,充分反应后过滤,滤液定容于250 mL容量瓶中。每次取25.00 mL加入稀硫酸酸化,用0.1000 mol/L的(NH4)2Fe(SO4)2标准溶液滴定,三次滴定消耗标准溶液的平均体积为18.93 mL。则上述样品中高铁酸钾的质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年甘肃省张掖市高三第三次诊断考试理综化学试卷(解析版) 题型:填空题
工业上常回收冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质),并用来生产ZnSO4·6H2O晶体,其工艺流程如下,有关氢氧化物沉淀时的pH如下表。
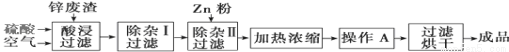
氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Zn(OH)2 |
开始沉淀的pH | 3.3 | 1.5 | 6.5 | 5.4 |
沉淀完全的pH | 5.2 | 3.7 | 9.7 | 8.0 |
(1)上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有 。
(2)在“除杂Ⅰ”步骤中,需再加入适量H2O2溶液的目的是 。
为使Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为 。
为控制上述PH范围可选择加入的试剂或药品是 。
A.ZnO B.氨水 C.固体NaOH D.ZnCO3
(3)在“除杂Ⅱ”步骤中,加入Zn粉的作用是 。“操作A”的名称是 。
(4)常温下,已知Ksp〔Cu(OH)2〕=2×10-20,某CuSO4溶液里c(Cu2+)=0.02 mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖南省益阳市高三下学期模拟考试理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列叙述正确的是
①常温常压下,18g14CH4所含中子数目为8 NA
②1L0.1mol·L-1的氨水中有NA个NH4+
③1mol Na2O2中含有NA个阴离子
④1L1mol·L-1NaClO 溶液中含有ClO-的数目为NA
⑤78g 苯含有C=C双键的数目为3NA
⑥0.1molN2和0.3molH2在某密闭容器中充分反应,转移电子的数目为0.6NA
⑦60gSiO2晶体中含有硅氧键的数目为4NA
A.①③⑦ B.②③⑥ C.②④⑥ D.①④⑤⑦
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖南省十三校高三第二次联考理综化学试卷(解析版) 题型:实验题
三苯甲醇(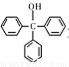 )是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图1所示,装置如图所示。
)是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图1所示,装置如图所示。
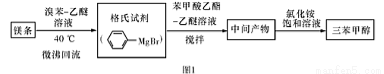
已知:(I)格氏试剂容易水【解析】
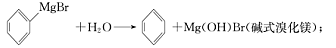
(Ⅱ)相关物质的物理性质如下:
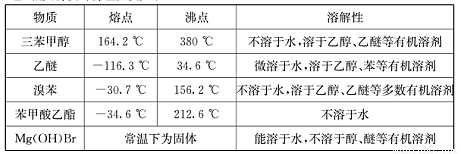
(Ⅲ)三苯甲醇的相对分子质量是260,纯净固体有机物一般都有固定熔点。
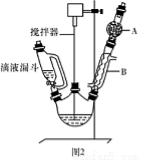
请回答以下问题:
(1)图2中玻璃仪器B的名称: ;装有无水CaCl2的仪器A的作用是 。
(2)图2中滴加液体未用普通分液漏斗而用滴液漏斗的作用是 ;制取格氏试剂时要保持微沸,可以采用 加热方式。
(3)制得的三苯甲醇粗产品中,含有乙醚、溴苯、苯甲酸乙酯等有机物和碱式溴化镁等杂质,可以设计如下提纯方案,请填写如下空白:

其中,①操作为: ;洗涤液最好选用 (从以下选项中选择);
A.水 B.乙醚 C.乙醇 D.苯
检验产品已经洗涤干净的操作为: 。
(4)纯度测定:称取2.60 g产品,配成乙醚溶液,加入足量金属钠(乙醚与钠不反应),充分反应后,测得生成的气体在标准状况下的体积为100.80mL。则产品中三苯甲醇的质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖北省天门市毕业生四月调研测试理综化学试卷(解析版) 题型:填空题
有机物A?M有如图所示转化关系,A与F分子中所含碳原子数相同,且均能与 NaHCO3溶液反应,F的分子式为C9H10O2,且不能使溴的CCl4溶液褪色;D能发生银镜反应;M与NaOH溶液反应后的产物,其一氯代物只有一种。
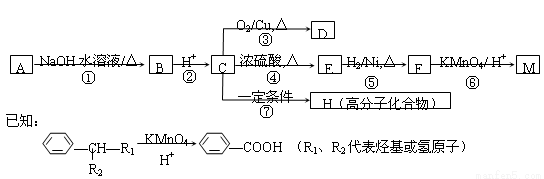
请回答:
(1)B、F的结构简式分别为 、 。
(2)反应①?⑦中,属于消去反应的是 (填反应序号)。
(3)D发生银镜反应的化学方程式为 ;反应⑦的化学方程式为 。
(4) A的相对分子质量在180~260之间,从以上转化中不能确认A中的某一官能团,确定该官能团的实验步骤和现象为 。
(5)符合下列条件F的同分异构体共有 种。
a.能发生银镜反应
b.能与FeCl3溶液发生显色反应
c.核磁共振氢谱上有四个峰,其峰面积之比为1:1:2:6
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖北省天门市毕业生四月调研测试理综化学试卷(解析版) 题型:选择题
将8.34 g FeSO4·7H2O样品隔绝空气加热脱水,其热重曲线(样品质量随温度变化的曲线)如右
图所示。则下列说法不正确的是
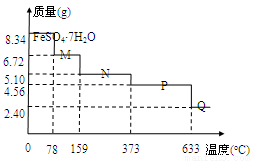
A.在100℃时,M的化学式为FeSO4·4H2O
B.FeSO4·7H2O晶体中有4种不同结合力的水分子
C.FeSO4·H2O存在的最高温度为373℃
D.380℃的P加热至650℃时的化学方程式为:2FeSO4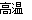 Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑
查看答案和解析>>
科目:高中化学 来源:2013-2014学年河南省商丘市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列叙述正确的是
A.标准状况下,22.4L正丁烷和异丁烷的混合物中所含共用电子对数为14NA
B.常温常压下,15.0g甲醛与葡萄糖的混合物中含有氢原子的数目为NA
C.60g SiO2晶体所含Si—O键的数目为2NA ,78 g苯含有C=C双键的数目为3NA
D.将CO2通过Na2O2使其增重a g时,反应中转移电子数为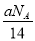
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江苏省高三百校联合调研测试(一)化学试卷(解析版) 题型:填空题
中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子 | K+ | Na+ | NH4+ | SO42- | NO3 | Cl- |
浓度/mol?L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据计算PM2.5待测试样的pH = 。
(2)NOx是汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
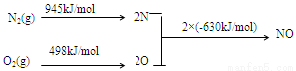
① N2(g)+O2(g) 2NO(g) △H= 。
2NO(g) △H= 。
② 当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式 。
③ 汽车汽油不完全燃烧时还产生CO,有人设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g),已知该反应的△H>0,该设想能否实现? 。你的依据是 。
(3)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
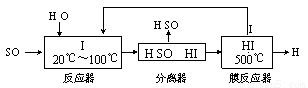
①用离子方程式表示反应器中发生的反应 。
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是 。
③用吸收H2后的稀土储氢合金作为电池负极材料(用MH)表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量、长寿命的镍氢电池。电池充放电时的总反应为:Ni(OH)2+M NiO(OH)+MH,电池放电时,负极电极反应式为 ; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极电极反应式为 。
NiO(OH)+MH,电池放电时,负极电极反应式为 ; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极电极反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com