
| A. | CH2=CH-CH3+Cl2$\stackrel{高温}{→}$CH2=CHCH2Cl+HCl | |
| B. | 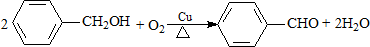 | |
| C. | 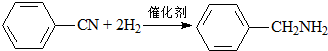 | |
| D. | 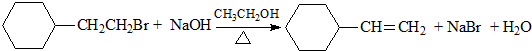 |
科目:高中化学 来源: 题型:解答题
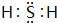 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 | |
| B. | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 | |
| C. | 人造黄油里的反式脂肪酸对健康不利,它是液态植物油加氢时产生的 | |
| D. | 新制的氢氧化铜可以检验病人是否患有糖尿病 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 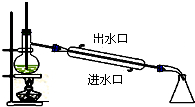 石油的蒸馏 | B. | 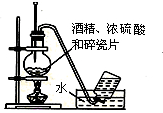 实验室用乙醇制乙烯 | ||
| C. | 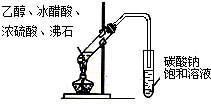 实验室制取乙酸乙酯 | D. | 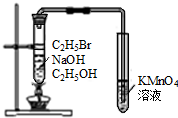 验证溴乙烷发生消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用新制备的Cu(OH)2悬浊液将乙醇、乙酸、葡萄糖、蔗糖几种溶液区别开 | |
| B. | 乙烯与HCl、乙烷与Cl2这两组反应均可得到CH3CH2Cl,但二者反应类型不同 | |
| C. | 分子中有三个甲基且分子式C6H14的烃最多有三种 | |
| D. | 苯能发生加成反应、取代反应但不能发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
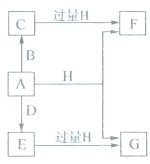
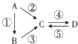 Ⅰ.A、B、C、D均为中学化学常见的纯净物,其中A是单质,它们之间有如图的转化关系.
Ⅰ.A、B、C、D均为中学化学常见的纯净物,其中A是单质,它们之间有如图的转化关系.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
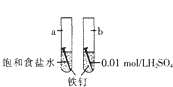
| A. | a是吸氧腐蚀,b是化学腐蚀 | |
| B. | a的负极反应时Fe-3e-═Fe3+ | |
| C. | a、b两处铁钉用导线联通有电流通过 | |
| D. | b前期发生析氢腐蚀,后期发生吸氧腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com