
分析 (1)氨气极易溶于水,氨气和水反应生成一水合氨,氨气溶于水的反应是一个可逆反应,该反应存在化学平衡,一水合氨是弱电解质,在水溶液中存在电离平衡;
(2)氨气和水反应生成的一水合氨属于电解质,但水、一水合氨是弱电解质,在水溶液中部分电离,存在电离平衡.
解答 解:(1)氨气极易溶于水,氨气溶于水的反应是一个可逆反应,氨气与水反应生成一水合氨,氨气溶于水的反应是一个可逆反应,所以反应方程式为:NH3+H2O?NH3•H2O,NH3•H2O为弱电解质,在溶液中部分电离出铵根离子和氢氧根离子,其电离方程式为:NH3•H2O?NH4++OH-,所以氨水中含有的分子有:NH3、H2O、NH3•H2O,
答:氨气与水反应的化学方程式为:NH3+H2O?NH3•H2O;氨水中含有的分子有:NH3、H2O、NH3•H2O;
(2)氨水中,水、一水合氨是弱电解质,在水溶液中存在电离平衡:H2O?H++OH-、NH3•H2O?NH4++OH-,所以氨水中存在的离子有:NH4+、OH-、H+,
答:水的电离方程式为:H2O?H++OH-、一水合氨的电离方程式为:NH3•H2O?NH4++OH-,氨水中存在的离子有:NH4+、OH-、H+.
点评 本题以氨水为例考查平衡移动原理、弱电解质的电离等知识点,明确物质性质是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 对于元素周期表和元素周期律的发现有突出贡献的科学家是阿伏加德罗 | |
| B. | 因为氯元素非金属性比硫元素强,所以次氯酸的酸性比硫酸强 | |
| C. | 每一周期都是从金属元素开始,非金属元素结束 | |
| D. | 现常见的元素周期表有七个横行,即七个周期,有18个纵行,分为16个族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径 | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
| A. | 元素②与元素③处于同一周期 | |
| B. | 元素④的原子序数小于元素⑦的 | |
| C. | 元素⑧的还原性比元素⑥的强 | |
| D. | 元素⑤的最高价氧化物对应水化物的酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
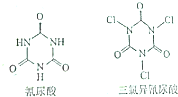 NA表示阿伏加德罗常数的值,下列说法中正确的有几项( )
NA表示阿伏加德罗常数的值,下列说法中正确的有几项( )| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,1L0.1mol/L的Na2CO3溶液中含有CO32-和HCO3-离子数之和为0.1NA | |
| B. | 标准状况下,11.2L丙烷中含有的极性共价键数目为4NA | |
| C. | 向Fel2溶液中通入适量Cl2,当有1molFe2+被氧化时,共转移的电子数目为NA | |
| D. | 标准状况下,22.4LCl2与足量NaOH溶液反应,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.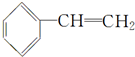 ,写出其发生加聚反应的化学方程式:
,写出其发生加聚反应的化学方程式: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
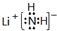 .
.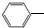 CH2CH3(g)?催化剂
CH2CH3(g)?催化剂 CH=CH2(g)+H2(g)
CH=CH2(g)+H2(g)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com