
| A. | 标准状况下,22.4 LCCl4含有的分子数为NA | |
| B. | 1L0.1 mol•L-1 Na2CO3溶液中含有CO32-数为0.1 NA | |
| C. | 常温常压下,18g水含有的分子数为 NA | |
| D. | 常温下,1mol Cl2与过量NaOH溶液反应,转移电子总数为2NA |
分析 A、标况下四氯化碳为液态;
B、碳酸根是弱酸根,在溶液中能水解;
C、水分子个数N=$\frac{m}{M}{N}_{A}$;
D、氯气和氢氧化钠的反应为歧化反应.
解答 解:A、标况下四氯化碳为液态,故不能根据气体摩尔体积来计算其物质的量和分子个数,故A错误;
B、碳酸根是弱酸根,在溶液中能水解,故溶液中含有的碳酸根的个数小于0.1NA个,故B错误;
C、水分子个数N=$\frac{m}{M}{N}_{A}$=$\frac{18g}{18g/mol}{N}_{A}/mol$=NA个,故C正确;
D、氯气和氢氧化钠的反应为歧化反应,故1mol氯气转移1mol电子即NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 亚硫酸是SO2与水反应的产物,显酸性 | |
| B. | SO2溶于水,剧烈反应生成亚硫酸 | |
| C. | 亚硫酸具有漂白性,能够使品红溶液褪色 | |
| D. | 亚硫酸不稳定,容易分解为水和SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
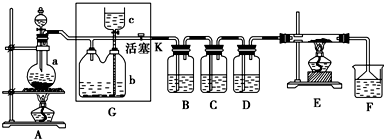
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH只适用于稀溶液,对于c(H+)>1 mol/L时,一般不用pH而直接用H+的浓度表示 | |
| B. | 水的电离、弱酸、弱碱的电离及盐类水解都是吸热的 | |
| C. | pH每增加一个单位,c(H+) 则减少10倍 | |
| D. | 25℃纯水中加入盐酸后,pH<7,此时水的离子积常数KW≠1×10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 “8•12”天津港危化仓库爆炸,造成生命、财产的特大损失.据查危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN).请回答下列问题:
“8•12”天津港危化仓库爆炸,造成生命、财产的特大损失.据查危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN).请回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠在电流的作用下电离出Na+和Cl- | |
| B. | CaCO3难溶于水,但CaCO3属于强电解质 | |
| C. | 二氧化碳溶于水能部分电离,故二氧化碳属于弱电解质 | |
| D. | 硫酸钠在水中的电离方程式可表示为Na2SO4═2Na++S6++4O2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
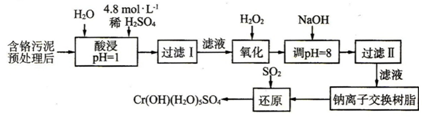
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | ─ | ─ | 4.7 | ─ |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com