
分析 (1)元素锡比同主族碳的周期数大3,二者原子序数相差第三、四、五周期容纳元素种数之和;
(2)Fe2(SO4)3将Sn2+全部氧化为Sn4+,再用溶液K2Cr2O7溶液滴定,将Fe2+氧化为Fe3+,根据电子转移守恒,整个过程关系式为:3Sn~3Sn2+~6Fe3+~6Fe2+~Cr2O72-,据此计算;
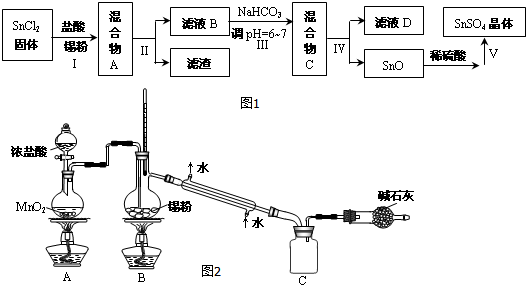
(3)由于Sn2+易水解、易被氧化,加入盐酸,抑制Sn2+水解,加入Sn粉可以与盐酸反应,调节溶液pH,还防止Sn2+被氧化,步骤Ⅱ为过滤,得SnCl2溶液,向其中加碳酸氢钠,调节溶液pH,使Mn元素以SnO形式沉淀,再过滤洗涤得纯净的SnO,加稀硫酸,得SnSO4溶液,加热浓缩、冷却结晶、过滤、洗涤,制得SnSO4晶体,滤液D中含有大量的NaCl等,
①由信息可知,Sn2+易被氧化,加入可防止Sn2+被氧化;
②步骤Ⅱ是过滤,根据过滤操作选用仪器;
③得到沉淀是SnO,Sn元素化合价为变化,属于非氧化还原反应,变质发生水解反应生成Sn(OH)2与二氧化碳,Sn(OH)2再脱水得到SnO;
④沉淀为SnO表面附着着Cl-,要想检验滤渣是否洗涤干净,用硝酸、硝酸银溶液检验最后一次洗涤液中是否含有Cl-;
(4)SnCl4水解得到Sn(OH)4与HCl,HCl与氨气反应得到NH4Cl;
由于SnCl4易水解,制备中应在干燥环境中进行,制备的氯气中含有HCl、水蒸气,需要除去,防止Sn与HCl反应,SnCl4水解;
熔融锡与氯气化合的反应是放热反应,且放出的热足够此反应持续进行.
解答 解:(1)元素锡比同主族碳的周期数大3,二者原子序数相差第三、四、五周期容纳元素种数之和,则Sn的原子序数为6+8+18+18=50,
故答案为:50;
(2)Fe2(SO4)3将Sn2+全部氧化为Sn4+,再用溶液K2Cr2O7溶液滴定,将Fe2+氧化为Fe3+,
设粉中锡的质量分数为x,则:
3Sn~3Sn2+~6Fe3+~6Fe2+~K2Cr2O7
3×119g 1mol
1.19g×x 0.100mol/L×0.02L
则:3×119g:1.19g×x=1mol:0.100mol/L×0.02L
解得:x=60%,
故答案为:将Sn2+全部氧化为Sn4+;60%;
(3)由于Sn2+易水解、易被氧化,加入盐酸,抑制Sn2+水解,加入Sn粉可以与盐酸反应,调节溶液pH,还防止Sn2+被氧化,步骤Ⅱ为过滤,得SnCl2溶液,向其中加碳酸氢钠,调节溶液pH,使Mn元素以SnO形式沉淀,再过滤洗涤得纯净的SnO,加稀硫酸,得SnSO4溶液,加热浓缩、冷却结晶、过滤、洗涤,制得SnSO4晶体,滤液D中含有大量的NaCl等,
①由信息可知,Sn2+易被氧化,加入Sn粉除调节溶液pH外,还防止Sn2+被氧化;
故答案为:防止Sn2+被氧化;
②步骤Ⅱ是过滤,用到的玻璃仪器除烧杯外,还有漏斗、玻璃棒,
故答案为:漏斗;玻璃棒;
③得到沉淀是SnO,Sn元素化合价为变化,属于非氧化还原反应,变质发生水解反应生成Sn(OH)2与二氧化碳,Sn(OH)2再脱水得到SnO,反应离子方程为:Sn2++2HCO3-=SnO↓+2CO2↑+H2O,
故答案为:Sn2++2HCO3-=SnO↓+2CO2↑+H2O;
④沉淀为SnO表面附着着Cl-,要想检验滤渣是否洗涤干净,用硝酸、硝酸银溶液检验最后一次洗涤液中是否含有Cl-,具体方案为:取最后一次滤液少许于试管中,依次滴加足量硝酸、少量硝酸银溶液,观察到无白色沉淀,说明洗涤干净
故答案为:取最后一次滤液少许于试管中,依次滴加足量硝酸、少量硝酸银溶液,观察到无白色沉淀;
⑤由流程图可知,操作V是从溶液中得到含结晶水的晶体,只能采取蒸发浓缩、冷却结晶、过滤、洗涤得到,
故答案为:蒸发浓缩、冷却结晶;
(4)SnCl4水解得到Sn(OH)4与HCl,HCl与氨气反应得到NH4Cl,反应方程式为:SnCl4+4NH3+4H2O=Sn(OH)4+4NH4Cl;
由于SnCl4易水解,制备中应在干燥环境中进行,制备的氯气中含有HCl、水蒸气,需要除去,防止Sn与HCl反应,SnCl4水解,改进方法是:在A、B装置间依次连接盛有饱和食盐水、浓硫酸的洗气瓶;
熔融锡与氯气化合的反应是放热反应,且放出的热足够此反应持续进行,
故答案为:SnCl4+4NH3+4H2O=Sn(OH)4+4NH4Cl;在A、B装置间依次连接盛有饱和食盐水、浓硫酸的洗气瓶;熔融锡与氯气化合的反应是放热反应,且放出的热足够此反应持续进行.
点评 本题考查制备方案的设计,题目难度较大,涉及物质制备方案、化学工艺流程、物质含量测定、元素周期表与元素周期律等知识,是对学生综合能力的考查,需要学生具备扎实的基础与良好的心理素质,明确实验目的、实验原理为解答关键.


 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:选择题
 室温下,将1.000mol•L-1盐酸滴入20.00mL 1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法不正确的是( )
室温下,将1.000mol•L-1盐酸滴入20.00mL 1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法不正确的是( )| A. | a点水的离子积Kw=1.0×10-14 | |
| B. | b点:c(NH4+)+c(H+)=c(Cl-)+c(OH-) | |
| C. | c点:c(Cl-)=c(NH4+) | |
| D. | d点后,溶液温度略下降的主要原因是NH3•H2O电离吸热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Y | Z | ||
| X | W |
| A. | 原子半径:X<Y<Z | |
| B. | 最高价氧化物的水化物的酸性:Y<W | |
| C. | 原子序数:X>W>Z>Y | |
| D. | Z、Y的单质均可与H2反应,且反应的剧烈程度:Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,v(正)变大,v(逆)变小 | |
| B. | 恒温恒容,平衡前后混合气体的密度保持不变 | |
| C. | 恒温恒压,充入N2,平衡不移动 | |
| D. | 恒温恒容,充入O2,O2的转化率升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C8H10中只有4种属于芳香烃的同分异构体 | |
| B. | CH3CH2CH2CH3光照下与氯气反应,生成2种一氯代烃 | |
| C. | 戊烷有3种同分异构体 | |
| D. | 甲苯苯环上的一个氢原子被-C3H7取代,所得产物有3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
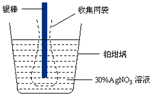 精确测量金属离子在惰性电极上以镀层形式沉积的金属质量,可以确定电解过程中通过电解池的电量.实际测量中常用的银电量计结构如图所示,下列说法不正确的是( )
精确测量金属离子在惰性电极上以镀层形式沉积的金属质量,可以确定电解过程中通过电解池的电量.实际测量中常用的银电量计结构如图所示,下列说法不正确的是( )| A. | 电量计中的银棒应与电源的正极相连,铂坩埚上发生的电极反应是:Ag++e-=Ag | |
| B. | 实验中,为了避免银溶解过程中可能产生的金属颗粒掉进铂坩埚而导致测量误差,常在银电极附近增加一个收集网袋.若没有收集网袋,测量结果会偏高 | |
| C. | 已知每摩尔电子的电量为965 00 C,若称量电解前后铂坩埚的质量变化值为108.0 mg,则电解过程中通过电解池的电量为96.5 C | |
| D. | 若要测定电解精炼铜时通过的电量,可将该银电量计中的银棒与待测电解池的粗铜电极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
| 其它 | 常温下该单质为黄色固体 | 无机非金属材料的主角 | 焰色反应呈黄色 | 其氧化物可做耐火材料 |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com