
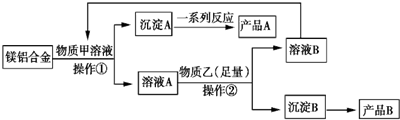
分析 镁铝合金材料经过物质甲溶液后,得到沉淀和溶液,所以甲是氢氧化钠溶液,沉淀A是镁,溶液A是氢氧化钠和偏铝酸钠的混合溶液,所以产品A是氧化镁,物质乙是二氧化碳,二氧化碳与混合液反应生成碳酸氢钠溶液,则溶液B是碳酸氢钠溶液,沉淀B是氢氧化铝,所以产品是氧化铝;
(1)用硬度大,密度小的材料制造的飞机轻巧、抗外力作用强,而铝合金的硬度大、密度小适合于制造飞机;
(2)物质甲是氢氧化钠溶液,产品A是氧化镁;
(3)操作①、②都是过滤,所以用的玻璃仪器是漏斗、烧杯、玻璃棒;
(4)足量物质二氧化碳与溶液偏铝酸钠溶液反应生成,碳酸氢钠和氢氧化铝,发生反应的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(5)实验室可以用石灰乳与碳酸钠反应生成烧碱,所以化学方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$ Na2CO3+CO2↑+H2O、Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
(6)氧化铝的质量为:$\frac{混合体系中铝元素的质量}{氧化铝中铝元素的质量分数}$.
解答 解:镁铝合金材料经过物质甲溶液后,得到沉淀和溶液,所以甲是氢氧化钠溶液,沉淀A是镁,溶液A是氢氧化钠和偏铝酸钠的混合溶液,所以产品A是氧化镁,物质乙是二氧化碳,二氧化碳与混合液反应生成碳酸氢钠溶液,则溶液B是碳酸氢钠溶液,沉淀B是氢氧化铝,所以产品是氧化铝;
(1)生铁和钢中含有碳易生锈,所以不能用制造运-20飞机发动机,硬度大,密度小的材料制造的飞机轻巧、抗外力作用强,而铝合金的硬度大、密度小适合于制造飞机,故选BC;
(2)物质甲是氢氧化钠溶液,产品A是氧化镁,故答案为:NaOH;MgO;
(3)操作①、②都是过滤,所以用的玻璃仪器是漏斗、烧杯、玻璃棒,故答案为:漏斗、烧杯、玻璃棒;
(4)足量物质二氧化碳与溶液偏铝酸钠溶液反应生成,碳酸氢钠和氢氧化铝,发生反应的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(5)实验室可以用石灰乳与碳酸钠反应生成烧碱,所以化学方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$ Na2CO3+CO2↑+H2O、Na2CO3+Ca(OH)2═CaCO3↓+2NaOH,故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$ Na2CO3+CO2↑+H2O、Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
(6)氧化铝的质量为:$\frac{混合体系中铝元素的质量}{氧化铝中铝元素的质量分数}$=$\frac{100kg×60%}{\frac{2×27}{2×27+48}×100%}$=133.3kg,故答案为:133.3.
点评 本题考查物质制备分离、阅读题目获取信息能力、化学方程式及离子方程式书写、化学计算等,需要学生具备扎实的基础及迁移运用能力,难度中等.


科目:高中化学 来源: 题型:解答题
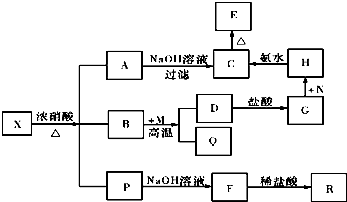
 X的化学式为Fe3C,P中气体的化学式为CO2、NO2.
X的化学式为Fe3C,P中气体的化学式为CO2、NO2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠和硫酸的反应 | B. | 葡萄糖在人体内氧化分解 | ||
| C. | Ba(OH)2•8H2O与NH4Cl反应 | D. | 锌粒与稀H2SO4反应制取H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 原电池是直接把化学能转化为电能的装置.
原电池是直接把化学能转化为电能的装置.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
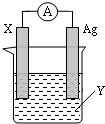 依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s) 设计的原电池如图所示.请回答下列问题:
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s) 设计的原电池如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)键线式:
(1)键线式: 表示的分子式C6H14,名称是2-甲基戊烷;
表示的分子式C6H14,名称是2-甲基戊烷;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用浓氨水和氢氧化钠制取氨气 | |
| B. | 加热蒸干AlCl3溶液不能得到无水AlCl3 | |
| C. | 工业上SO2和O2在常压下生成SO3 | |
| D. | 水中的c(H+)比0.1mol/LNaOH溶液中的c(H+)大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com