

分析 Ⅰ.(1)制备气体需要发生装置和收集装置,尾气处理装置,依据制备气体用的原料的状态和反应条件选择合适的发生装置;氯气有毒,不能直接排放到空气中,能够与氢氧化钠溶液反应,可以用氢氧化钠溶液吸收氯气;
(2)依据氧化还原反应规律:氧化性强的制取氧化性弱的物质选择合适的试剂;
Ⅱ.(3)依据仪器图型,说出其名称;铜与浓硝酸反应生成二氧化氮、硝酸铜和水;
(4)根据二氧化氮溶于水形成压强差分析;二氧化氮与水反应生成硝酸,溶液显酸性.
解答 解:Ⅰ.(1)制备气体需要发生装置和收集装置,尾气处理装置,实验室用固体二氧化锰与液体浓盐酸,在加热条件下制备氯气,所以应选择发生装置A;
氯气有毒,不能直接排放到空气中,能够与氢氧化钠溶液反应,可以用氢氧化钠溶液吸收氯气,装置图为: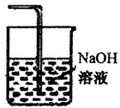 ;
;
故答案为:A  ;
;
(2)比较Cl-和Br-还原性强弱,需在装置C中盛装的溶液溴化钾(或溴化钠)溶液,若氯气氧化性强于溴,则能够置换溴单质;
故答案为:溴化钾(或溴化钠)溶液;
Ⅱ.(3)B中仪器e的名称为长颈漏斗;铜与浓硝酸反应生成二氧化氮、硝酸铜和水,离子方程式:
Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;
故答案为:长颈漏斗;Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;
(4)若二氧化氮能和水反应,则烧杯内气体的压强会减小,小于外界大气压,烧杯中的溶液会倒流于试管甲,所以先关闭止水夹b、d,再打开止水夹 c,双手紧握(或微热)试管丁使试管中气体逸出,NO2与水接触后水倒流,使烧杯中的水进入试管甲,二氧化氮与水反应生成硝酸,溶液显酸性,紫色石蕊试液变为红色;
看到的现象为:烧杯中有气泡冒出,随后水倒流至试管甲中,甲中溶液显红色;
故答案为:双手紧握(或微热)试管甲使试管中气体逸出;烧杯中有气泡冒出,随后水倒流至试管甲中,甲中溶液显红色.
点评 本题考查了气体的制备和性质的检验,熟悉氯气、二氧化氮制备原理和性质是解题关键,侧重于学生的分析能力和实验能力的考查,题目难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革还原剂.它受热、遇酸易分解.工业上可用反应:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2制得,实验室模拟该工业过程的装置如图所示.(说明:a中盛放稀硫酸;b中盛放Na2SO3固体)回答下列问题:
硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革还原剂.它受热、遇酸易分解.工业上可用反应:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2制得,实验室模拟该工业过程的装置如图所示.(说明:a中盛放稀硫酸;b中盛放Na2SO3固体)回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量二氧化锰与浓盐酸共热反应 | |
| B. | 过量的氢气与少量氮气在一定条件下充分反应 | |
| C. | 过量铜与浓硫酸共热反应 | |
| D. | 过量氨水与硝酸银溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由同种元素组成的物质肯定是纯净物 | |
| B. | 凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布 | |
| C. | 含有金属元素的离子一定都是阳离子 | |
| D. | 两种原子若核外电子排布相同,则一定属于同种元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 将10gNaCl晶体溶入90g水中,制得10%的NaCl溶液 | |
| B. | 将40gNaOH溶于1L水中,所得溶液中NaOH的物质的量浓度为1mol/L | |
| C. | 将wga%的NaCl溶液蒸发掉$\frac{w}{2}$g水,得到2a%的NaCl溶液 | |
| D. | 将1体积c1mol/L的硫酸用水稀释为5体积,稀溶液的浓度为0.2 c1mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com