
分析 (1)二者互溶,但沸点不同,加CaO可增大沸点差异;
(2)二者互溶,但沸点不同;
(3)二者溶解度受温度影响不同;
(4)加饱和碳酸钠溶液、分液;
(5)乙烯与溴水反应,而甲烷不反应;
(6)泥沙不溶于水;
(7)溴不易溶于水,易溶于有机溶剂;
(8)HCl与饱和碳酸氢钠溶液反应生成二氧化碳.
解答 解:(1)二者互溶,但沸点不同,加CaO可增大沸点差异,则分离方法为新制生石灰,蒸馏,故答案为:新制生石灰,蒸馏;
(2)二者互溶,但沸点不同,则蒸馏可分离,故答案为:蒸馏;
(3)二者溶解度受温度影响不同,则选择结晶或重结晶法分离,故答案为:结晶或重结晶;
(4)加饱和碳酸钠溶液、分液,则选择分液法分离,故答案为:分液;
(5)乙烯与溴水反应,而甲烷不反应,则选择洗气法分离,故答案为:洗气;
(6)泥沙不溶于水,则溶解过滤可除杂,故答案为:溶解过滤;
(7)溴不易溶于水,易溶于有机溶剂,则选择有机溶剂萃取分离,故答案为:萃取;
(8)HCl与饱和碳酸氢钠溶液反应生成二氧化碳,则洗气可除杂,故答案为:洗气.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、混合物分离方法为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 选项 | 微粒组 | 所加试剂 | 离子方程式 |
| A | NH4+、Fe2+、SO42- | 少量Ba(OH)2溶液 | 2NH4++SO42-+Ba2++2OH-═BaSO4↓+2NH3•H2O |
| B | Mg2+、Cl-、HCO3- | 过量NaOH溶液 | Mg2++2HCO3-+4OH-═Mg(OH)2↓+2CO32-+2H2O |
| C | Fe2+、NO3-、HSO3- | NaHSO4溶液 | HSO3-+H+═SO2↑+H2O |
| D | K+、CO32-、NH3•H2O | 通入少量CO2 | CO32-+CO2+2H2O═2HCO3- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
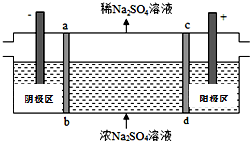 三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室.下列叙述正确的是( )
三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室.下列叙述正确的是( )| A. | 通电后中间隔室的SO42-离子向正极迁移,正极区溶液碱性增强 | |
| B. | 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品 | |
| C. | 阴极区溶液pH降低,阳极区溶液pH升高 | |
| D. | 当电路中通过1mol电子的电量时,会有0.5mol的O2生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将322 g Na2SO4•10H2O溶于1 L水中,所得溶液的物质的量浓度为1 mol/L | |
| B. | 将含2 mol H2SO4的溶液加水稀释到2 L,所得溶液中H2SO4的物质的量浓度为1 mol/L | |
| C. | 将1 L 18.4 mol/L的H2SO4溶液加入1 L水中,所得溶液的物质的量浓度为9.2 mol/L | |
| D. | 将336 mL HCl气体溶于300 mL水,所得溶液的物质的量浓度为0.05 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
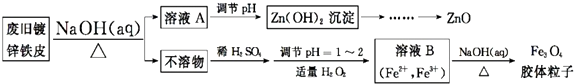
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验必须使用温度计,且温度计的水银球应在蒸馏烧瓶的支管口处 | |
| B. | 冷凝管中的水流方向是从下口进入,上口排出 | |
| C. | 实验中需要在蒸馏烧瓶中加入几片碎瓷片,防止出现暴沸现象 | |
| D. | 用酒精灯加热时,蒸馏烧瓶必须垫石棉网 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1013的溶液中:NH4+、Ca2+、C1-、K+ | |
| B. | 澄清透明的无色溶液中:K+、Mg2+、NO3-、MnO4- | |
| C. | 使pH试纸呈红色的溶液中:I-、Cl-、NO3-、Na+ | |
| D. | 含有较多的Al3+的溶液中:K+、Ca2+、S2-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com