
A.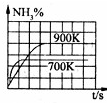 N2(g)+3H2(g)  2NH3(g)△H=-92.4kJ/mol |
B.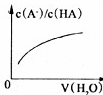 向弱酸HA的稀溶液中加水稀释 |
C.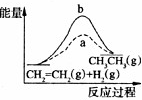 有催化剂(a)和无催化剂(b)时反应的能量变化 |
D.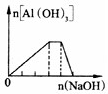 向NH4Al(SO4)2溶液中滴加过量NaOH溶液 |
| c(A-) |
| c(HA) |
| n(A-) |
| n(HA) |
| c(A-) |
| c(HA) |


科目:高中化学 来源: 题型:
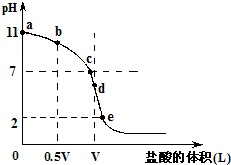 常温,向浓度为0.1mol/L,体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应.根据图象回答下列问题:
常温,向浓度为0.1mol/L,体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应.根据图象回答下列问题:| c(H+) |
| c(OH-) |
| c(NH4+)?c(OH-) |
| c(NH3H2O) |
| c(NH3H2O)?c(H+) |
| c(NH4+) |
| 11V |
| 9 |
| 11V |
| 9 |
查看答案和解析>>
科目:高中化学 来源:2013年浙江省绍兴一中高考化学模拟试卷(解析版) 题型:选择题

 2NH3(g)△H=-92.4kJ/mol
2NH3(g)△H=-92.4kJ/mol


查看答案和解析>>
科目:高中化学 来源:2011年山东省德州市高考化学二模试卷(解析版) 题型:选择题

 2NH3(g)△H=-92.4kJ/mol
2NH3(g)△H=-92.4kJ/mol


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com