
【题目】下列各项有机化合物的命名或分类正确的是( )
A.2,3﹣二甲基﹣2﹣乙基己烷
B.CH3CH2CH2Cl 氯丙烷
C.![]() 属于芳香化合物
属于芳香化合物
D.![]() 属于羧酸
属于羧酸
 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
【题目】请回答下列问题:
I.工业生产纯碱的工艺流程示意图如下:

(1)为除去粗盐水中的Mg2+、Ca2+、SO42-等杂质离子,加入试剂顺序合理的是________。
A.碳酸钠、氢氧化钠、氯化钡 B.碳酸钠、氯化钡、氢氧化钠
C.氢氧化钠、碳酸钠、氯化钡 D.氯化钡、氢氧化钠、碳酸钠
(2)工业生产纯碱工艺流程中,碳酸化时产生的现象是________________。
(3)碳酸化后过滤,滤液A最主要的成分是______________(填写化学式),检验这一成分的阴离子的具体方法是:________________________________。
(4)煅烧制取Na2CO3在_______(填字母序号)中进行。
a.瓷坩埚 b.蒸发皿 c.铁坩埚 d.氧化铝坩埚
II.纯碱在生产生活中有广泛的用途。
(5)工业上,可能用纯碱代替烧碱生产某些化工产品。如用饱和纯碱溶液与氯气反应可制得有效成分为次氯酸钠的消毒液,其反应的离子方程式为________________________。
(6)纯碱可制备重铬酸钠(Na2Cr2O7),铬铁矿中的1molCr2O3反应时需要通入标准状况下O2的体积为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2L的密闭容器中,加入1mol X(g)和2mol Y(g)发生反应:X(g)+mY (g)3Z(g)△H<0,平衡时,X和Y的转化率都是10%.下列叙述不正确的是( )
A.m=2
B.达平衡时,Z的体积分数为10%
C.达平衡后,保持容器体积不变,加热,容器内压强将增大
D.将平衡后的容器体积压缩至1L,X的浓度为0.45molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表各组物质中,物质之间不可能实现如图 ![]() 所示转化的是( )
所示转化的是( )
选项 | X | Y | Z | M |
A | Fe(s) | FeCl2 | FeCl3 | Cl2 |
B | NaOH(aq) | Na2CO3 | NaHCO3 | CO2 |
C | NH3(g) | NO | NO2 | O2 |
D | S(s) | SO2 | SO3 | O2 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,将盛有20mL NO2和O2的混合气体的大试管倒立在水槽中,水面上升至一定位置后不再变化,此时还有3mL气体,则原混合气体中的NO2的体积可能是( )
A.17.8 mL
B.14.8 mL
C.12.6 Ml
D.12.4 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】奶粉中蛋白质含量的测定往往采用“凯氏定氮法”,其原理是食品与硫酸和催化剂一同加热,使蛋白质分解,分解的氨与硫酸结合生成硫酸铵。然后碱化蒸馏使氨游离,用硼酸吸收后再以硫酸或盐酸标准溶液滴定,根据酸的消耗量乘以换算系数,即为蛋白质含量。
操作步骤:①样品处理:准确称取一定量的固体样品奶粉,移入干燥的烧杯中,经过一系列的处理,待冷却后移入一定体积的容量瓶中。
②NH3的蒸馏和吸收:把制得的溶液(取一定量)通过定氮装置,经过一系列的反应,使氨变成硫酸铵,再经过碱化蒸馏后,氨即成为游离态,游离氨经硼酸吸收。
③氨的滴定:用标准盐酸溶液滴定所生成的硼酸铵,由消耗的盐酸标准液计算出总氮量,再折算为粗蛋白含量。
试回答下列问题:
(1)在配制过程中,下列哪项操作可能使配制的溶液的浓度偏大________(填字母)。
A.烧杯中溶液转移到容量瓶中时,未洗涤烧杯
B.定容时,俯视刻度线
C.定容时,仰视刻度线
D.移液时,有少量液体溅出
(2)若称取样品的质量为1.5 g,共配制100 mL的溶液,取其中的20 mL,经过一系列处理后,使N转变为硼酸铵后用0.1 mol·L-1盐酸滴定,其用去盐酸的体积为23.00 mL,则该样品中N的含量为________(保留两位小数)。[已知:滴定过程中涉及到的反应方程式:(NH4)2B4O7+2HCl+5H2O===2NH4Cl+4H3BO3]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程中,只包含物理过程的是( )
A.蛋白质溶液中加入饱和(NH4)2SO4溶液B.石灰粉刷的墙壁日久变硬
C.自来水生产时的“沉降”过程D.用“氧立得”制取氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究钠、铁、铜及其化合物具有重要意义。
(1)有50mLNaOH溶液,向其中逐渐通入一定量的CO2,随后向溶液中逐渐加入的0.1mol/L盐酸,产生的气体CO2体积(标准状况下) 与所加入的盐酸的体积之间的关系如图所示:
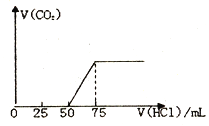
试计算:
(1)向NaOH 溶液中通入CO2气体后,所得溶液中的溶质是_______,反应产生的CO2气体体积(标准状况) 是_______L。
(2)向Ba (OH)2溶液中,逐滴加入NaHSO4溶液至恰好不再生成沉淀为止,写出发生反应的离子方程式_______________,若在上述反应后溶液中继续滴加NaHSO4溶液,写出此步反应的离子方程式: _______________ 。
(3)NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。某厂废弃液中,含有2%~5%的NaNO2 直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是_____。
A.KMnO4 B.NH4Cl C.O2 D.HNO3
(4)向含Fe(NO3)3、 Cu(NO3)2、HNO3 的稀溶液中逐渐加入铁粉,c(Fe2+)的变化如图所示。
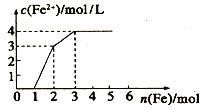
①横坐标0~1段反应的离子方程式为:_____________。
②忽略溶液体积的变化,则原溶液Cu(NO3)2的浓度为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com