
| A. | ②③⑤ | B. | ②③④⑥ | C. | ①③④⑤ | D. | ①②③ |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:①混合气体的平均相对分子质量,说明气体的质量不变,反应达平衡状态,故正确;
②混合气体的密度,说明气体的质量不变,反应达平衡状态,故正确;
③B的物质的量浓度不变,说明生成B和消耗B的速率相等,故正确;
④气体总物质的量一直不变,故错误;
⑤混合气体的压强始终不变,压强不变的状态不一定平衡,故错误;
⑥v(C)与v(D)的比值,只要反应发生两者的比值就是1:1,不发生变化,故错误;
故选D.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:解答题
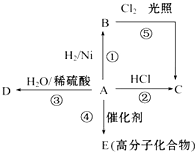 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型.根据图回答下列问题:
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型.根据图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
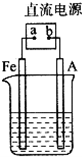 某地区常下酸雨,因而使金属制品锈蚀严重,铁制品镀铜可以有效防止铁的锈蚀,右图所示为铁制品镀铜的过程,请据此回答下列问题:
某地区常下酸雨,因而使金属制品锈蚀严重,铁制品镀铜可以有效防止铁的锈蚀,右图所示为铁制品镀铜的过程,请据此回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
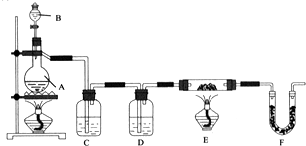
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
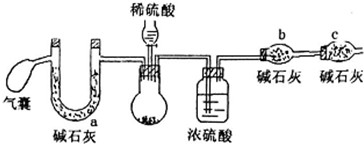
| 氢氧化钠浓度(mol•L-1) | 5 | 2 | 1 | 0.01 |
| 溶液变红后褪色的时间(s) | 8 | 94 | 450 | 长时间不褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
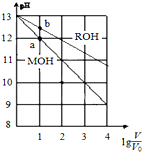 pH相同、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示.下列叙述正确的是( )
pH相同、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示.下列叙述正确的是( )| A. | MOH的物质的量浓度大于ROH | |
| B. | 水的电离程度:b点大于a点 | |
| C. | 两溶液在稀释过程中,溶液中各离子浓度都减少 | |
| D. | 当lg$\frac{V}{{V}_{0}}$=2时,若两溶液同时升高温度,则$\frac{c({M}^{+})}{c({R}^{+})}$减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 同一原子中,轨道的能量高低:1s>2s>3s>4s | |
| B. | 同一原子中,轨道的能量高低:3s<3p<3d | |
| C. | 不同能级中含有的原子轨道数:s-2;p-6;d-10 | |
| D. | M层上所具有的原子轨道数共有9个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com