
【题目】向100mL含HCl的AlCl3溶液中逐滴加入0.1mol·L-1的NaOH溶液,加入NaOH溶液的体积V(mL)与产生Al(OH)3沉淀的物质的量n(mol)的关系如图:

试计算:(请写出运算过程)
(1)原溶液中HCl的物质的量浓度。____________
(2)原溶液中AlCl3的物质的量浓度。____________
【答案】0.05mol/L 0.05mol/L
【解析】
(1)由图知:加入NaOH溶液50mL时,HCl被完全中和,发生反应:NaOH+Cl=NaCl+H2O,可知n(HCl)=n(NaOH),再根据c=![]() 计算;
计算;
(2)由图知:加入NaOH溶液(200-50)mL═150mL时,Al3+离子被全部沉淀,发生反应Al3++3OH-=Al(OH)3↓,据此计算n(AlCl3),再根据c=![]() 计算。
计算。
(1)由图知:加入NaOH溶液50mL时,HCl被完全中和,发生反应:NaOH+HCl=NaCl+H2O,可知n(HCl)=n(NaOH),所以c(HCl)═![]() =0.05mol/L;
=0.05mol/L;
(2)由图知:加入NaOH溶液(20050)mL═150mL时,Al3+离子被全部沉淀,发生反应:Al3++3OH=Al(OH)3↓,可知n(AlCl3)=3n(NaOH),所以:c(AlCl3)=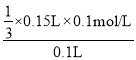 =0.05mol/L。
=0.05mol/L。


科目:高中化学 来源: 题型:
【题目】已知:N2O4(g)![]() 2NO2(g) △H=+QkJ/mol (Q>0),80℃时在2L密闭容器中充入0.40 mol N2O4,发生反应获得如下数据:
2NO2(g) △H=+QkJ/mol (Q>0),80℃时在2L密闭容器中充入0.40 mol N2O4,发生反应获得如下数据:
时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
c(NO2)/mol/L | 0.00 | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
下列判断正确的是
A. 升高温度会使混合气体的颜色变浅
B. 反应达平衡时,吸收的热量为0.30Q kJ
C. 20~40s内,v(N2O4)=0.004mol/(L·s)
D. 100s时再充入0.40mo1N2O4,达到新平衡时N2O4的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组用镍触媒废料(主要成分为Ni-Al合金,混有少量Fe、Cu、Zn及有机物) 制备NiO并回收金属资源的流程如下所示:

已知:相关数据如表1和表2所示
表1部分难溶电解质的溶度积常数(25℃)
物质 | Ksp | 物质 | Ksp |
Fe(OH)3 | 4.0×10-38 | CuS | 6.3×10-34 |
Fe(OH)2 | 1.8×10-16 | ZnS | 1.6×10-24 |
Al(OH)3 | 1.0×10-33 | NiS | 3.2×10-18 |
Ni(OH)2 | 2.0×10-15 |
表2 原料价格表
物质 | 价格/(元吨-1) |
漂液(含25.2%NaClO) | 450 |
双氧水(含30%H2O2) | 2400 |
烧碱(含98%NaOH) | 2100 |
纯碱(含99.5%Na2CO3) | 600 |
请回答下列问题:
(1)“焙烧”的目的是________________________________。
(2)“试剂a”的名称为__________________;选择该试剂的理由是______。
(3)“氧化”时反应的离子方程式为__________________________________________。
(4)欲使溶液中Fe3+和A13+的浓度均小于等于1.0×10-6 mol L-1,需“调节pH”至少为_______________。
(5)“试剂b”应选择__________,“加水煮沸”时,反应的化学方程式为_______________________________。
(6)氢镍电池是一种应用广泛的二次电池,放电时,该电池的总反应为NiOOH+MH=Ni(OH)2+M,当导线中流过2 mol电子时,理论上负极质量减少__________g。充电时的阳极反应式为_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一固定体积的密闭容器中加入反应物A、B,发生如下反应:A+2B=3C。反应经2min后,A的浓度从开始时的1.0mol/L降至0.8 mol/L。已知反应开始时B的浓度是1.2 mol/L。求:
(1)用A来表示2 min内该反应的平均速率______;
(2)2min末C的浓度_______;
(3)2min末B的转化率_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有下列五种物质A.食盐, B.食醋,C.苹果汁,D.葡萄糖,E.青霉素,请按下列要求填空(填序号)。
富含维生素C的是____;可直接进入血液,补充能量的是___ ;应用最广泛的抗生素之一的是____;即可作为调味剂,又可作为防腐剂、着色剂的是____;食用过多会引起血压升高、肾脏受损的____。
(2)已知维生素A1的键线式如下,线的交点与端点处代表碳原子,并用氢原子补足四价,但C、H原子未标记出来。

回答下列问题:
①维生素A是一类重要的维生素,又称视黄醇,它属于_____(填“水溶性”或“脂溶性”)维生素;如果人体内缺少维生素A,易患_____等眼疾(任写一种), 维生素A含量较高的蔬菜有______。
②维生素A1的结构简式如上图,推测它____使溴水褪色(填“能”或“否”),若1mol维生素A1分子最多可跟_____mol H2发生加成反应。
(3)保持洁净安全的生存环境已成为全人类的共识。
①为了改善空气质量,必须控制大气中二氧化硫、氮氧化物、烟尘等污染物的排放量。为控制大气中二氧化硫的排放,常采取的措施是对化石燃料进行______。对汽车加装尾气催化净化装置,使其中的有害气体NO、CO转化为无害气体,该反应的化学方程式为______。
②获得洁净安全的饮用水是每个人的正常需要。某农村地区为获得饮用水,在将地表水取回家后,常使用漂白粉或漂白精片进行杀菌消毒,其原理可用化学方程式表示为_______。
③人类产生的垃圾应进行分类回收、集中处理,即便如此,仍会剩余不少垃圾,因此必须对剩余垃圾进一步处理,除卫生填埋外,还有一种能够改变垃圾的组成、结构使其体积减小、充分利用其所具有的能量并使之无害化的处理方式,这种垃圾的处理方式是_____技术。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表的叙述中正确的是( )
A. 元素周期表中第8、9、10三个纵行为第Ⅷ族
B. 碱金属元素是指ⅠA族的所有元素
C. 除第1周期外,其他周期均有18种元素
D. 7个横行代表7个周期,18个纵行代表18个族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏二甲肼与N2O4是常用的火箭推进剂,二者发生如下化学反应:(CH3)2NNH2(l)+2N2O4(l)=2CO2(g)+3N2(g)+4H2O(g) (Ⅰ)
(1)反应(Ⅰ)中氧化剂是_________。
(2)火箭残骸中常出现红棕色气体,是因为:N2O4(g)![]() 2NO2(g)(Ⅱ)。当温度升高时,气体颜色变深,则反应(Ⅱ)为____________(填“吸热”或“放热”)反应。
2NO2(g)(Ⅱ)。当温度升高时,气体颜色变深,则反应(Ⅱ)为____________(填“吸热”或“放热”)反应。
(3)550℃时,将2.0molSO2和1.0molO2置于5L密闭容器中,反应达平衡后,下列措施中能使n(SO3)/n(SO2)增大的是_____________。
A.升高温度
B.充入He(g),使体系总压强增大
C.再充入2.0molSO2和1.0molO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】开发氢能是实现社会可持续发展的需要。硫铁矿(FeS2)燃烧产生的SO2通过下列碘循环工艺过程既能制H2SO4,又能制H2。

请回答下列问题:
(1)已知1g FeS2完全燃烧放出7.1kJ热量,FeS2的标准燃烧△H=______________。
(2)上图中循环工艺过程的总反应方程式为__________________________________。
(3)用吸收H2后的稀土储氢合金作为电池负极材料(用MH)表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量,长寿命的镍氢电池。电池充放电时的总反应为:Ni(OH)2+M ![]() NiO(OH)+MH,电池放电时,负极的电极反应式为____________________________________。
NiO(OH)+MH,电池放电时,负极的电极反应式为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠易溶于水,水溶液显碱性,有氧化性,也有还原性。由于NaNO2有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
NaNO2+KI+ →NO↑+I2+K2SO4+Na2SO4+ ____
(1)请完成该化学方程式并配平。
(2)将上述反应方程式改写为离子反应方程式:_____
(3)用上述反应来处理NaNO2并不是最佳方法,其原因是__。从环保角度来讲,要处理NaNO2,所用的物质的___(填“氧化性”或“还原性”)应该比KI更__(填“强”或“弱”)。
(4)简便鉴别亚硝酸钠和氯化钠的方法是____。
(5)已知亚硝酸钠可以与氯化铵反应生成氮气和氯化钠,写出该反应的化学反应方程式并用单线桥表示其电子转移的方向和数目。___
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com