
【题目】己知反应A(g)+B(g)![]() C(g)+D(g)的平衡常数和温度的关系如下:
C(g)+D(g)的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
请回答下列问题:
(1)该反应平衡常数表达式为K=_______;△H=_______0(选填“>”、“<”或“=”)。
(2)830℃时,向一个5L的密闭容器中充入0.40mol的A和0.60mol的B,反应在6min时达到平衡状态。
①该段时间内A的平均反应速率v(A)=__________,达到平衡时B的转化率为_________。
②如果这段时间内体系向外释放48kJ的热量,写出该反应的热化学方程式:_________。
③此时向该密闭容器中充入1mol氩气,平衡时A的转化率_______(选填“增大”、“减小”、“不变”)。
(3)判断该反应达到平衡的依据为_________(填正确选项的字母)。
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时间改变 d.单位时间里生成C和D的物质的量相等
e.单位时间内生成amolA的同时,消耗amolB
(4)1200℃时反应C(g)+D(g)![]() A(g)+B(g)的平衡常数的值为_________。
A(g)+B(g)的平衡常数的值为_________。
【答案】 K= ![]() < 8×10-3mol/(Lmin) 40% A(g) + B(g)
< 8×10-3mol/(Lmin) 40% A(g) + B(g) ![]() C(g) + D(g) ΔH =-200kJ/mol 不变 ce 2.5
C(g) + D(g) ΔH =-200kJ/mol 不变 ce 2.5
【解析】试题分析:本题考查化学平衡常数表达式的书写,影响化学平衡常数和化学平衡的因素,化学平衡的计算,化学平衡状态的判断,热化学方程式的书写。
(1)根据化学方程式可直接写出K=![]() 。根据表中数据分析,升高温度化学平衡常数减小,即升高温度平衡逆向移动,正反应为放热反应,ΔH
。根据表中数据分析,升高温度化学平衡常数减小,即升高温度平衡逆向移动,正反应为放热反应,ΔH![]() 0。
0。
(2)①设从起始到平衡过程中转化A的物质的量为x,用三段式
A(g)+B(g)![]() C(g)+D(g)
C(g)+D(g)
n(起始)(mol) 0.4 0.6 0 0
n(转化)(mol) x x x x
n(平衡)(mol) 0.4-x 0.6-x x x
查表830℃时平衡常数为1.0,则[![]() ]/[
]/[![]() ]=1.0,解得x=0.24mol,υ(A)=0.24mol
]=1.0,解得x=0.24mol,υ(A)=0.24mol![]() 5L
5L![]() 6min=8×10-3mol/(Lmin);达平衡时B的转化率为0.24mol
6min=8×10-3mol/(Lmin);达平衡时B的转化率为0.24mol![]() 0.6mol
0.6mol![]() 100%=40%。
100%=40%。
②如果这段时间内体系向外释放48kJ的热量,反应消耗0.24molA向外释放48kJ的热量,则消耗1molA向外释放![]() =200kJ,该反应的热化学方程式为A(g) + B(g)
=200kJ,该反应的热化学方程式为A(g) + B(g) ![]() C(g) + D(g) ΔH =-200kJ/mol。
C(g) + D(g) ΔH =-200kJ/mol。
③此时向该密闭容器中充入1mol氩气,由于各物质的浓度都不变,平衡不发生移动,平衡时A的转化率不变。
(3)a项,该反应是气体分子数不变的反应,建立平衡过程中气体物质的量始终不变,恒容时压强始终不变,压强不随时间改变不能作为平衡的标志;b项,所有物质都是气体,气体的总质量始终不变,容器的体积不变,气体的密度始终不变,气体的密度不随时间改变不能作为平衡的标志;c项,c(A)不随时间改变表明反应达到平衡状态;d项,C和D都是生成物且化学计量数之比为1:1,单位时间里生成C和D的物质的量始终相等,单位时间里生成C和D的物质的量相等不能作为平衡的标志;e项,单位时间内生成amolA的同时,消耗amolB,即正、逆反应速率相等,达到平衡状态;答案选ce。
(4)查表知1200℃时反应A(g)+B(g) ![]() C(g)+D(g)的K=0.4,则反应C(g)+D(g)
C(g)+D(g)的K=0.4,则反应C(g)+D(g)![]() A(g)+B(g)的平衡常数K=
A(g)+B(g)的平衡常数K=![]() =
=![]() =2.5。
=2.5。


科目:高中化学 来源: 题型:
【题目】磁性材料A是由两种元素组成的化合物,某研究小组按如图流程探究其组成:
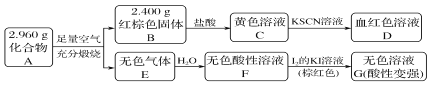
请回答:
(1)A的组成元素为________(用元素符号表示),化学式为_____________________。
(2)溶液C可溶解铜片,例举该反应的一个实际应用________。
(3)已知化合物A能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标况下的密度为1.518 g·L-1),该气体分子的电子式为________。写出该反应的离子方程式____________________。
写出F→G反应的化学方程式___________________________________。
设计实验方案探究溶液G中的主要微粒(不考虑H2O、H+、K+、I-) _____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学实验说法正确的是( )
A.用磨口玻璃塞的细口瓶盛放Na2CO3溶液
B.用酸式滴定管量取20.00 mL硫酸
C.电镀时,通常把镀层金属作阴极
D.中和反应反应热的测定实验中用到的所有玻璃仪器为烧杯、量筒、温度计
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下物质间的每步转化通过一步反应能实现的是( )
A.Al→Al2O3→Al(OH)3→NaAlO2
B.Si→SiO2→H2SiO3→Na2SiO3
C.N2→NO→NO2→HNO3
D.S→SO3→H2SO4→MgSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列做法利于环境保护的是
A. 燃烧废旧电线提取铜线
B. 工业废水直接排入河流、湖泊中
C. 淘汰落后产能,将污染严重的企业从城市迁往农村
D. 减少化石能源的使用,大力发展太阳能、风能等新能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4 -+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。某实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计方案如下(KMnO4溶液已酸化):
实验序号 | A溶液 | B溶液 |
① | 20mL 0.lmol·L-l H2C2O4溶液 | 30mL 0.01mol.L-l KMnO4溶液 |
② | 20mL 0.2mol·L-l H2C2O4溶液 | 30mL 0.01mol.L-l KMnO4溶液 |

(1)该实验探究的是______对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是_____(填实验序号)。
(2)若实验①在2min末注射器的活塞向右移动到了b mL的位置,则这段时间的反应速率可表示为v(CO2)=______mL/min。若实验②在t min收集了4.48×10-3L CO2(标准状况下),则t min末c(MnO4-)=______。
(3)该小组同学发现反应速率总是如图二,其中t1~t2时间内速率变快的主要原因可能是:①___________、②___________。
(4)已知草酸是一种二元弱酸,其电离常数K1=5.4×10-2、K2=5.4×10-5,写出草酸的电离方程式_______、________。试从电离平衡移动的角度解释K1>>K2的原因_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )。
A. 根据反应Cu+H2SO4![]() CuSO4+H2↑可推知Cu的还原性比H2的强
CuSO4+H2↑可推知Cu的还原性比H2的强
B. 在反应CaH2+2H2O===Ca(OH)2+2H2↑中,水作氧化剂
C. 反应3NO2+H2O===2HNO3+NO中氧化剂和还原剂的物质的量之比是3∶1
D. Cl2的氧化性强于I2的氧化性,故置换反应I2+2NaClO3===2NaIO3+Cl2不能发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在50 m L 0.1mol/L Na2S 溶液中逐滴加入50 mL 0.1mol/L KHSO4溶液,所得溶液中粒子浓度关系正确的是
A. c(SO42-)= c(HS-)= c(K+)>c(OH-)= c(H+)
B. c(Na+)> c(K+)> c(S2-)> c(H+)> c(OH-)
C. c(Na+)= c(S2-)+ c(HS-)+ c(H2S)+ c(SO42-)
D. c(K+)+ c(Na+)+ c(H+)= c(SO42-)+ c(S2-)+ c(HS-)+ c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com