
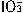 和I-发生反应:
和I-发生反应: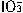 +5I-+6H+=3I2+3H2O,据此反应,可用试纸和生活中常见的物质进行实验,证明食盐中存在
+5I-+6H+=3I2+3H2O,据此反应,可用试纸和生活中常见的物质进行实验,证明食盐中存在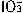 ,可供选择的物质有:①自来水、②蓝色石蕊试纸、③碘化钾淀粉试纸、④淀粉、⑤白糖、⑥食醋、⑦白酒。进行以上实验时必须使用的物质是()。
,可供选择的物质有:①自来水、②蓝色石蕊试纸、③碘化钾淀粉试纸、④淀粉、⑤白糖、⑥食醋、⑦白酒。进行以上实验时必须使用的物质是()。 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是某加碘盐包装袋上的部分文字说明.
|
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3g/100gH2O | 8.08 | 12.6 | 18.3 | 24.8 |
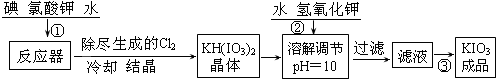
| 操 作 步 骤 | 实验现象 |
| 取1g纯净的NaCl,加3mL水配成溶液. | 溶液无变化 |
| 滴入5滴淀粉溶液和1mL 0.1mol/L KI溶液,振荡. | 溶液无变化 |
| 然后再滴入1滴1mol/L的H2SO4,振荡. | 溶液变蓝色 |
查看答案和解析>>
科目:高中化学 来源:09-10年海南嘉积中学高一下学期期末考试化学卷(文科) 题型:选择题
为实现消除碘缺乏症的政府目标,卫生部门规定食盐必须加碘,其中的碘以碘酸钾(KIO3)形式存在。已知在溶液中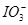 和
和 可发生反应:
可发生反应: 。根据上述反应,可用试纸和一些生活中常见的物质进行实验,证明食盐中存在
。根据上述反应,可用试纸和一些生活中常见的物质进行实验,证明食盐中存在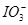 。可供选用的物质有:①自来水;②蓝色石蕊试纸;③碘化钾淀粉试纸;④淀粉;⑤食糖;⑥食醋;⑦白酒。进行上述实验时必须使用的物质是
。可供选用的物质有:①自来水;②蓝色石蕊试纸;③碘化钾淀粉试纸;④淀粉;⑤食糖;⑥食醋;⑦白酒。进行上述实验时必须使用的物质是
A、③⑥ B、①③ C、②④⑥ D、①②④⑤⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com