
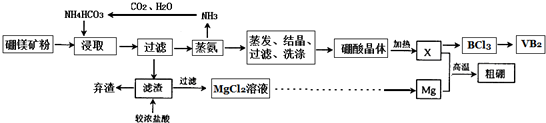
分析 浸取过程中发生反应:2MgO+2B2O3+2NH4HCO3+H2O═2NH4H2BO3+2MgCO3↓,SiO2不反应,过滤分离,滤渣含有SiO2、MgCO3,利用水解原理进行蒸氨,得到氨气循环利用,经过蒸发、结晶、过滤、洗涤得到硼酸,加热分解得到B2O3.滤渣用浓盐酸溶解,SiO2不反应,碳酸镁与盐酸反应,过滤分离得到氯化镁溶液,经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到氯化镁晶体,电解熔融的氯化镁得到Mg,Mg与B2O3发生置换反应得到B.
(1)充分浸取后过滤,所得滤渣的主要成分是:SiO2、MgCO3;浸取过程中温度过高,碳酸氢铵会分解;
(2)电解熔融的氯化镁生成金属镁,还生成氯气;
(3)Mg与B2O3发生置换反应得到B,还生成MgO;硼的性质与铝相似,能与NaOH溶液反应,而Mg与氢氧化钠不反应;
(4)已知:①4B(s)+3O2(g)═2B2O3(s)△H=-2520kJ/mol
②2H2(g)+O2(g)═2H2O(g)△H=-484kJ/mol
③H2O(l)═H2O(g)△H=+44kJ/mol
根据盖斯定律,②×$\frac{3}{2}$-①×$\frac{1}{2}$-③×3可得:3H2(g)+B2O3(s)=2B(s)+3H2O(l);
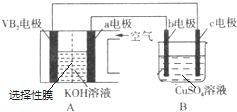
(5)该电池工作时的反应为:4VB2+11O2═4B2O3+2V2O5,碱性条件下,VB2极发生氧化反应反应得到B2O3、V2O5,有氢氧根离子参与反应,同时有水生成;
B装置为电解池,阳极生成氧气,阴极首先写成Cu,铜离子放电完毕,氢离子放电生成氢气,根据电子转移守恒计算生成氧气的物质的量,进而计算生成氢气物质的量,再根据电子转移守恒计算电解前CuSO4的物质的量;
(6)根据B元素守恒可得:B2O3~2H3BO3,将浸出率、损失率均转化为B2O3的利用率,结合关系式计算.
解答 解:浸取过程中发生反应:2MgO+2B2O3+2NH4HCO3+H2O═2NH4H2BO3+2MgCO3↓,SiO2不反应,过滤分离,滤渣含有SiO2、MgCO3,利用水解原理进行蒸氨,得到氨气循环利用,经过蒸发、结晶、过滤、洗涤得到硼酸,加热分解得到B2O3.滤渣用浓盐酸溶解,SiO2不反应,碳酸镁与盐酸反应,过滤分离得到氯化镁溶液,经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到氯化镁晶体,电解熔融的氯化镁得到Mg,Mg与B2O3发生置换反应得到B.
(1)充分浸取后过滤,所得滤渣的主要成分是:SiO2、MgCO3;浸取过程中温度过高,会使加入的NH4HCO3分解,导致浸取率降低,
故答案为:SiO2、MgCO3;温度过高会使加入的NH4HCO3分解;
(2)电解熔融的氯化镁生成金属镁,还生成氯气,反应方程式为:MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑,
故答案为:MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑;
(3)Mg与B2O3发生置换反应得到B,还生成MgO,反应方程式为:B2O3+3Mg $\frac{\underline{\;高温\;}}{\;}$ 3MgO+2B,硼的性质与铝相似,能与NaOH溶液反应,而Mg与氢氧化钠不反应,证明粗硼中含有少量镁的化学方法是:向粗硼中加入足量NaOH溶液,充分反应后固体未完全溶解,
故答案为:B2O3+3Mg $\frac{\underline{\;高温\;}}{\;}$ 3MgO+2B;向粗硼中加入足量NaOH溶液,充分反应后固体未完全溶解;
(4)已知:①4B(s)+3O2(g)═2B2O3(s)△H=-2520kJ/mol
②2H2(g)+O2(g)═2H2O(g)△H=-484kJ/mol
③H2O(l)═H2O(g)△H=+44kJ/mol
根据盖斯定律,②×$\frac{3}{2}$-①×$\frac{1}{2}$-③×3可得:3H2(g)+B2O3(s)=2B(s)+3H2O(l)△H=+402kJ/mol,
故答案为:3H2(g)+B2O3(s)=2B(s)+3H2O(l)△H=+402kJ/mol;
(5)该电池工作时的反应为:4VB2+11O2═4B2O3+2V2O5,碱性条件下,VB2极发生氧化反应反应得到B2O3、V2O5,有氢氧根离子参与反应,同时有水生成,电极反应式为:2 VB2+22 OH--22e-=V2O5+2B2O3+11 H2O,
B装置为电解池,阳极生成氧气,根据电子转移守恒可知氧气为$\frac{0.04mol}{4}$=0.01mol,生成气体总物质的量为$\frac{0.448L}{22.4L/mol}$=0.02mol,故生成氢气为0.01mol,由电子转移守恒,电解前CuSO4的物质的量为$\frac{0.04mol-0.01mol×2}{2}$=0.01mol,故电解前CuSO4溶液的物质的量浓度为$\frac{0.01mol}{0.2L}$=0.05mol/L,
故答案为:2 VB2+22 OH--22e-=V2O5+2B2O3+11 H2O;0.05;
(6)设可制得xkg硼酸,则:
B2O3~~~~~~~~~~~2H3BO3
69.6 2×61.8
200×103 kg×20%×69.6%×(1-10%) x kg
所以69.6:2×61.8=200×103 kg×20%×69.6%×(1-10%):x kg
解得x=44496,
故答案为:44496.
点评 本题考查物质制备工艺流程、热化学方程式书写、电解原理、利用关系式进行的有关计算等,题目素材比较陌生,增大题目难度,较好地考查学生分析解决问题的能力、知识迁移运用能力.


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铜与盐酸反应:H++OH-═H2O | |
| B. | 氯化钙溶液与碳酸钠溶液反应:Ca2++CO32-═CaCO3↓ | |
| C. | 硫酸溶液与碳酸钡反应:Ba2++SO42-═BaSO4↓ | |
| D. | 碳酸钙与稀盐酸反应:CO32-+2H+═H2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
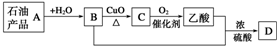
| A. | A能使酸性高锰酸钾溶液褪色 | B. | 可用B萃取碘水中的碘单质 | ||
| C. | B与乙酸发生了取代反应 | D. | D的结构简式为CH3COOCH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
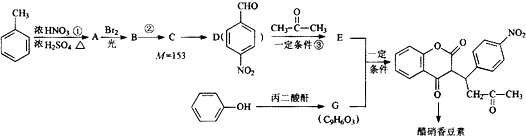
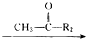 R1-CH═
R1-CH═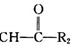 +H2O
+H2O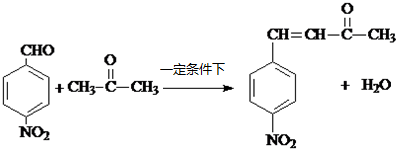 .
. .
.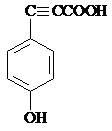 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 装 置 图 |  | 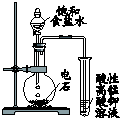 | 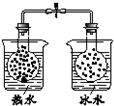 |  |
| 现 象 | 导管中液面上升 | KMnO4溶液褪色 | 热水中的NO2球红棕色加深 | 白色沉淀逐渐转化为黄色沉淀 |
| 结 论 | 该条件下,铁钉发生吸氧腐蚀 | 电石和水反应生成乙炔 | 2NO2(g)?N2O4(g)△H<0 | Ksp:AgCl>AgI |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
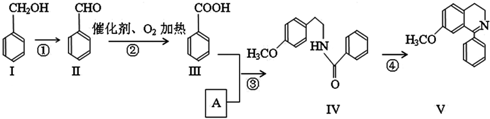
 +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2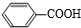
 +
+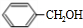 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O
+H2O
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
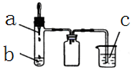 利用如图所示装置进行下列实验,实验现象与结论均正确的是( )
利用如图所示装置进行下列实验,实验现象与结论均正确的是( )| 选项 | 实验试剂 | 实验现象 | 实验结论 | ||
| a | b | c | |||
| A | 浓氨水 | 碱石灰 | FeCl2溶液 | 产生白色沉淀,迅速变为灰绿色,最后变为红褐色 | 氨气具有氧化性 |
| B | 稀硫酸 | FeS | AgCl悬浊液 | 悬浊液由白色变为黑色 | Ksp(AgCl)>Ksp(Ag2S) |
| C | 浓硝酸 | 铜 | BaSO3悬浊液 | 悬浊液变澄清 | +4价硫具有还原性 |
| D | 浓盐酸 | KMnO4 | 紫色石蕊试液 | 溶液先变红后褪色 | Cl2有酸性和漂白性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由X、Y、Z三种元素形成的某种化合物,可能含有离子键 | |
| B. | 五种元素分别形成的单核离子中,M的离子半径最大 | |
| C. | W的氯化物是由一种10e-离子和一种18e-离子构成的 | |
| D. | X元素与Z所在主族的各元素形成的A2B型化合物中X2Z沸点最低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 工业上,可以由下列反应合成三聚氰胺:
工业上,可以由下列反应合成三聚氰胺: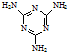 .其中氮原子的杂化方式有sp2、sp3.
.其中氮原子的杂化方式有sp2、sp3.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com