
下列说法中正确的是( )
A.含有非极性共价键的化合物分子一定是非极性分子
B.原子晶体中只存在非极性共价键
C.冰主要是水分子通过氢键作用而形成的分子晶体
D.若元素R的含氧酸的酸性大于元素Q的含氧酸的酸性,则非金属性R大于Q
科目:高中化学 来源: 题型:
下列性质适合于离子晶体的是( )
A.熔点1 070℃,易溶于水,水溶液能导电
B.熔点10.31℃,液态不导电,水溶液能导电
C.能溶于CS2,熔点112.8℃,沸点444.6℃
D.熔点97.81℃,质软,导电,密度0.97 g·cm-3
查看答案和解析>>
科目:高中化学 来源: 题型:
物质结构理论推出:金属晶体中金属阳离子与自由电子之间的强烈的相互作用,叫金属键。金属键越强,其金属的硬度越大,熔、沸点越高,且据研究表明,一般说来金属原子半径越小,价电子数越多,则金属键越强。由此判断下列说法错误的是( )
A.镁的硬度小于铝
B.镁的熔、沸点低于钙
C.镁的硬度大于钾
D.钙的熔、沸点高于钾
查看答案和解析>>
科目:高中化学 来源: 题型:
现有甲、乙、丙三种晶胞,如图所示。
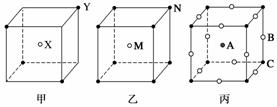
甲中X处于晶胞中心;乙中M处于晶胞中心;丙中A处于晶胞中心,B处于棱上,C处于顶点。由此可知:
(1)甲晶胞中X与Y的个数之比为________________________________________。
(2)乙晶胞中M与N的个数之比为________________________________________。
(3)丙的化学式是_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列晶体性质的比较中不正确的是( )
A.熔点:金刚石>碳化硅>晶体硅
B.沸点:NH3>PH3
C.硬度:白磷>冰>二氧化硅
D.熔点:SiI4>SiBr4>SiCl4
查看答案和解析>>
科目:高中化学 来源: 题型:
德国和美国科学家首次研制出了由20个碳原子组成的空心笼状分子C20,该笼状结构是由多个正五边形构成的(如图所示)。请回答:
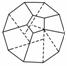
(1)C20分子中共有________个正五边形,共有 条棱边。C20晶体属于________(填晶体类型)。
(2)固体C60与C20相比较,熔点较高的应为________,理由是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
苯分子不能使酸性KMnO4溶液褪色的原因是( )
A.分子中不存在π键
B.分子中存在6电子大π键,结构稳定
C.分子是平面结构
D.分子中只存在σ键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com