
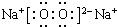 ,其中含有的化学键是离子键、共价键.
,其中含有的化学键是离子键、共价键.分析 原子序数由小到大排列的四种短周期元素X、Y、Z、W,其中X、Z、W与氢元素可组成XH3、H2Z和HW共价化合物,则X为N;Y与氧元素可组成Y2O和Y2O2离子化合物,Y为Na,Z为S,W为Cl.
(1)过氧化钠中钠离子与过氧根离子通过离子键结合,两个氧原子通过共价键结合;
(2)Z为硫元素,依据相对分子质量在170~190之间,且Z的质量分数约为70%计算硫原子个数、氮原子个数;
(3)X、Z、W三种元素的最高价氧化物对应的水化物,分别为硝酸、硫酸、高氯酸;
(4)依据氨气为碱性气体的性质解答;
(5)由X、W组成的化合物分子中,X、W原子的最外层均达到8电子稳定结构,则该化合物为NCl3,遇水可生成一种具有漂白性的化合物及次氯酸,结合原子个数守恒书写方程式.
解答 解:原子序数由小到大排列的四种短周期元素X、Y、Z、W,其中X、Z、W与氢元素可组成XH3、H2Z和HW共价化合物,则X为N;Y与氧元素可组成Y2O和Y2O2离子化合物,Y为Na,Z为S,W为Cl.
(1)过氧化钠中钠离子与过氧根离子通过离子键结合,两个氧原子通过共价键结合,所以含有的化学键类型为离子键、共价键,电子式为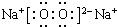 ,
,
故答案为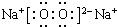 ;离子键、共价键;
;离子键、共价键;
(2)Z为硫元素,在周期表中的位置是第 三周期、第ⅥA;X和Z形成的一种二元化合物具有温室效应,其相对分子质量在170~190之间,且Z的质量分数约为70%,则含硫的个数介于$\frac{170×70%}{32}$≈3.7,$\frac{190×70%}{32}$≈4.2,所以S原子个数为4,相对分子质量为:$\frac{4×32}{0.7}$=183,则氮原子数为$\frac{183×30%}{14}$≈4,分子式为:S4N4;
故答案为:三;ⅥA;S4N4;
(3)X、Z、W三种元素的最高价氧化物对应的水化物分别为:HNO3 H2SO4 HClO4,三种酸稀溶液中硝酸的氧化性最强;
故答案为:HNO3;
(4)氨气为碱性气体,与硫化氢、氯化氢都能反应生成铵盐,故答案为:NH3;
(5)由X、W组成的化合物分子中,X、W原子的最外层均达到8电子稳定结构,则该化合物为NCl3,遇水可生成一种具有漂白性的化合物次氯酸和氨气,反应的方程式:NCl3+3H2O═3HClO+NH3;
故答案为:NCl3+3H2O═3HClO+NH3.
点评 本题考查位置、结构及性质的应用,为高频考点,把握元素化合物知识推断元素为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 比较这两种元素的单质的硬度和熔点 | |
| B. | 向氯化铝和氯化镁的溶液中分别滴加过量的氢氧化钠溶液 | |
| C. | 使在空气中久置的镁带和铝片分别与热水作用,并滴入酚酞溶液 | |
| D. | 将铝片和镁片分别投入氢氧化钠溶液中,Al能与NaOH溶液反应放出氢气,而Mg不能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
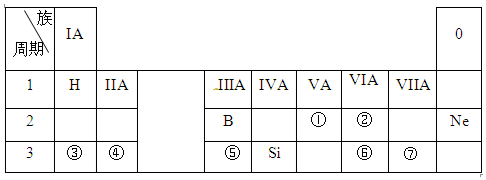
| A. | ①②④⑤ | B. | ①②④⑦ | C. | ①②⑥⑦ | D. | ③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
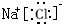 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| X | ||
| Y | ||
| Z |
| A. | Z一定是活泼的金属 | |
| B. | Y的最高化合价为+7价 | |
| C. | Z的最高价氧化物的水化物是强酸 | |
| D. | 1molY单质与足量水反应时,有2mol电子发生转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
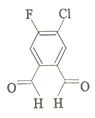 今年春节期间,一个名叫“福(氟)禄(氯)双全(醛)”的物质 (结构简式如图)在化学人的朋友圈中火了起来.该物质属于( )
今年春节期间,一个名叫“福(氟)禄(氯)双全(醛)”的物质 (结构简式如图)在化学人的朋友圈中火了起来.该物质属于( )| A. | 单质 | B. | 无机物 | C. | 有机物 | D. | 氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池总反应:CH4+2O2+2OH-═CO32-+3H2O | |
| B. | 负极反应式:CH4-8e-+10OH-═CO32-+7H2O | |
| C. | 正极反应式:O2+4H++4e-═2H2O | |
| D. | CH4燃料电池比CH4直接燃烧能量利用率高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
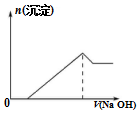
| A. | 硫酸铝铵中Al3+的水解程度比明矾中Al3+的水解程度大 | |
| B. | 该物质的水溶液中Na+、K+、Cl-、S2-都可大量共存 | |
| C. | 向该物质的溶液中滴加同浓度的NaOH溶液的体积与生成沉淀的关系如图所示 | |
| D. | 向该物质的溶液中滴加Ba(OH)2溶液,使SO42-恰好完全沉淀的离子方程式为:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3•H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com