氮化硅(Si
3N
4)是一种优良的高温结构陶瓷,在工业生产和科技领域中有重要用途.
Ⅰ.工业上有多种方法来制备氮化硅,常见的方法:
方法一 直接氮化法:在1 300~1 400℃时,高纯粉状硅与纯氮气化合,其反应方程式为
.
方法二 化学气相沉积法:在高温条件下利用四氯化硅气体、纯氮气、氢气反应生成氮化硅和HCl,与方法一相比,用此法制得的氮化硅纯度较高,其原因是
.
方法三 Si(NH
2)
4热分解法:先用四氯化硅与氨气反应生成Si3N4和一种气体
(填分子式);然后使Si(NH
2)
4受热分解,分解后的另一种产物的分子式为
.
Ⅱ.(1)氮化硅抗腐蚀能力很强,但易被氢氟酸腐蚀,氮化硅与氢氟酸反应生成四氟化硅和一种铵盐,此盐中存在的化学键类型有
.
(2)已知:25℃,101kPa条件下的热化学方程式:
3Si(s)+2N2(g)═Si3N4(s)△H=-750.2kJ/mol ①
Si(s)+2C12(g)═SiCl4(g)△H=-609.6kJ/mol ②
H2(g)+
C12(g)═HCl(g)△H=-92.3kJ/mol ③
请写出四氯化硅气体与氮气、氢气反应的热化学方程式:
.
Ⅲ.工业上制取高纯硅和四氯化硅的生产流程如下:
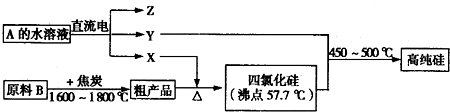
已知:X、高纯硅、原料B的主要成分都可与Z反应,Y与X在光照或点燃条件下可反应,Z的焰色呈黄色.
(1)原料B的主要成分是
(填化学式).
(2)写出焦炭与原料B中的主要成分反应的化学方程式:
.
(3)上述生产流程中电解A的水溶液时,阳极材料能否用Cu?
(填“能”或“不能”).写出Cu为阳极电解A的水溶液开始一段时间阴、阳极的电极反应方程式.阳极:
;阴极:
.





