
| A. | 对于2HI(g)?H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深 | |
| B. | 溴水中有下列平衡Br2+H2O?HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅 | |
| C. | 合成氨反应,为提高氨的产率,理论上应采取降低温度的措施 | |
| D. | 反应CO(g)+NO2(g)?CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深 |
分析 勒夏特列原理是:如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动.勒夏特列原理适用的对象应存在可逆过程,若与可逆过程无关,与平衡移动无关,则不能用勒夏特列原理解释.
解答 解:A、由H2、I2(g)、HI组成的平衡体系,存在H2+I2?2HI,缩小体积,压强增大,平衡不移动,不能用勒夏特列原理解释,故A正确;
B、加入硝酸银溶液后,会和HBr之间反应,所以平衡正向移动,溶液颜色变浅,能用勒夏特列原理解释,故B错误;
C、合成氨反应是放热的反应,增大压强,会促使平衡正向移动,可以提高氨的产率,能用勒夏特列原理解释,故C错误.
D、反应 CO+NO2?CO2+NO (△H<0),达平衡后,提高温度会使得平衡逆向移动,二氧化氮浓度增大,颜色加深,能用勒夏特列原理解释,故D错误;
故选A.
点评 本题考查了勒夏特列原理的使用条件,难度不大,注意使用勒夏特列原理的前提必须是可逆过程,且平衡发生移动.


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:实验题
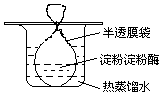 把一定量的淀粉和少量淀粉酶配成溶胶灌于半透膜袋中并置于盛有热的蒸馏水的烧杯中(如图所示).一段时间后进行如下实验,回答相关问题.
把一定量的淀粉和少量淀粉酶配成溶胶灌于半透膜袋中并置于盛有热的蒸馏水的烧杯中(如图所示).一段时间后进行如下实验,回答相关问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向试管中滴加试剂时,将滴管下端紧靠试管内壁 | |
| B. | 不能用燃着的酒精灯去点燃另一酒精灯 | |
| C. | 使用试纸检验溶液的性质时,将试纸浸入溶液中 | |
| D. | 加完药品后应将滴管洗净后再放回原瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能全部透过半透膜 | B. | 所得物质一定为悬浊液或乳浊液 | ||
| C. | 所得混合物一定能导电 | D. | 有丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
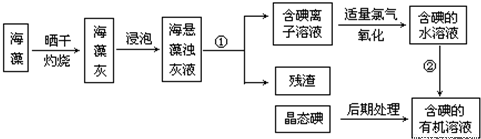
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
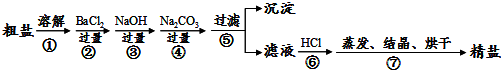
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
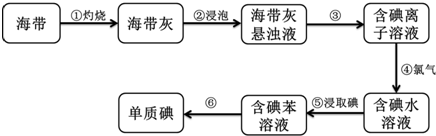
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com