
【题目】按如图所示装置进行实验,将液体A逐滴加入到固体B中,下列叙述不正确的是
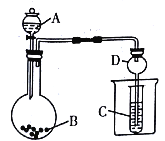
A. 若A为浓盐酸,B为KMnO4,C中盛品红溶液,则C中溶液褪色
B. 若A为醋酸,B为贝壳,C中盛Na2SiO3 溶液,则C中溶液变浑浊
C. 若A为浓氨水,B为生石灰,两者混合后产生NH3,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀溶解
D. 仪器D可以起到防止溶液倒吸的作用
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 阳离子只有氧化性,阴离子只有还原性
B. 含氧酸可作氧化剂,而无氧酸不能
C. 在8NH3+3Cl2===N2+6NH4Cl反应中,氧化剂与还原剂分子个数之比是2:3
D. 已知还原性:Fe2+>Br-,可知反应2Fe3++2Br-===2Fe2++Br2不易进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值.下列说法正确的是( )
A.0.1 molL﹣1MgCl2溶液中含有的Mg2+数目一定小于0.1NA
B.标准状况下,11.2 L CCl4中含有的分子数目为0.5NA
C.4.6g由NO2和N2O4组成的混合物中含有氧原子的数目为0.2 NA
D.1 mol CH5+中含有的电子数目为11NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向一定体积0.1molL﹣1的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液pOH[pOH=﹣lgc(OH﹣)]与pH的变化关系如图所示,则( ) 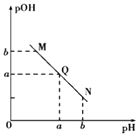
A.N点处pH>pOH,则N点处所示溶液呈酸性
B.该温度下水的离子积Kw=1×10﹣2a
C.Q点所示溶液呈中性,则M,N,Q三点中只有Q点溶液中水的电离出的c(H+)与水的电离c(OH﹣)相等
D.M点所示溶液的导电能力强于Q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与滴定实验有关的说法中正确的是( )
A.容量瓶和滴定管都需要用试剂润洗
B.用NaOH滴定盐酸时,若滴定结束时俯视刻度,会导致测定结果偏高
C.用滴定管准确量取20.0 mL盐酸
D.用KMnO4滴定亚硫酸钠溶液的实验中不需要另外加入指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁粉、铜粉、FeCl3溶液和CuCl2溶液混合于某容器中充分反应(假定容器不参与反应)。试判断下列情况下,容器中存在的金属离子和金属单质。
(1)若铁粉有剩余,则容器中不可能有的离子是________,铜单质______(填“一定”或“可能”)存在。
(2)若CuCl2有剩余,则容器中还可能有的离子为________,铜单质______(填“一定”或“可能”)存在。
(3)若FeCl3和CuCl2都有剩余,则容器中不可能有的单质是______,Fe2+_____(填“一定”或“可能”)存在。
(4)将6g铁粉加入200mLFe2(SO4)3和CuSO4的混合溶液中,充分反应得到200mL 0.5mol/LFeSO4溶液和5.2g固体沉淀物,则原Fe2(SO4)3和CuSO4的混合溶液中Fe2(SO4)3的物质的量浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同温度下水的离子积常数如表所示:
t/℃ | 0 | 10 | 20 | 25 | 40 | 50 | 100 |
KW/10﹣14 | 0.114 | 0.292 | 0.681 | 1.00 | 2.92 | 5.47 | 55.0 |
①请用文字解释随温度升高水的离子积增大的原因:
②25℃条件下,pH=4的盐酸溶液中由水电离出来的H+的浓度为mol/L
③10℃时纯水的电离平衡常数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列反应中,HCl作还原剂的是( )
A. NaOH + HCl = NaCl + H2O
B. Zn + 2HCl = ZnCl2 + H2↑
C. MnO2 + 4HCl(浓)![]() MnCl2 + 2H2O + Cl2↑
MnCl2 + 2H2O + Cl2↑
D. CuO + 2HCl = CuCl2 + H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com