
| A. | ${\;}_{92}^{235}$U可用于制造原子弹,也可用作核电站发电的原料 | |
| B. | 利用${\;}_{6}^{14}$C可判断某些文物的生产年代 | |
| C. | 等质量的${\;}_{1}^{2}$H2O、${\;}_{1}^{1}$H2O所含的分子数前者多 | |
| D. | 通过化学反应无法将${\;}_{1}^{2}$H转化为${\;}_{1}^{1}$H |
分析 A.铀元素是放射性元素,发生核裂变过程中发出大量能量;
B.14C能发生衰变,用于考古;
C.计算二者摩尔质量,比较等质量的物质物质的量大小,分子数之比等于其物质的量之比;
D.通过化学反应能生成新的分子不能生成新的原子.
解答 解:A.${\;}_{92}^{235}$U是放射性元素,能发生核裂变释放大量能量,可用于制造原子弹,也可用作核电站发电的原料,故A正确;
B.12C和14C质子数相同中子数不同,14C能发生衰变,考古时利用l4C测定一些文物的年代,故B正确;
C.等质量的${\;}_{1}^{2}$H2O、${\;}_{1}^{1}$H2O,其摩尔质量分别为20g/mol和18g/mol,等质量时前者物质的量小,分子数少,故C错误;
D.化学反应实质是原子重新组合,${\;}_{1}^{2}$H和${\;}_{1}^{1}$H为同种元素的不同原子,化学性质相同,无法将${\;}_{1}^{2}$H转化为${\;}_{1}^{1}$H,故D正确;
故选C.
点评 本题考查核素的应用、同位素原子的性质、物质的量的计算等知识,题目难度不大,注意同位素原子间不能通过化学反应实现.


科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水:Cl2+H2O=2H++C1-+C1O- | |
| B. | 铝溶于过量的氨水:A1+2OH-+H2O=A1O2-+2H2↑ | |
| C. | 检验溶液中的 NH4+:NH4++OH-$\frac{\underline{\;加热\;}}{\;}$NH3↑+H2O | |
| D. | 用 H2S 处理含 Hg2+的废水:S2-+Hg2+=HgS↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最终可生成0.4molSO3 | |
| B. | 当v正(O2)=v逆(SO2)=0时一定达化学平衡 | |
| C. | 升高温度反应速率减小 | |
| D. | 缩小体积增大压强反应速率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法正确的是( )
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法正确的是( )| A. | 该电池工作时电能转化为化学能 | |
| B. | 有1mol电子转移时,反应的氧气为5.6L | |
| C. | 外电路中电流由电极b通过导线流向电极a | |
| D. | 电极b的反应为:O2+4e-+H2O=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 瓶中气体的黄绿色逐渐变浅 | |
| B. | 瓶内壁有油状液滴形成 | |
| C. | 此反应的生成物只有一氯甲烷 | |
| D. | 此反应的液态生成物为二氯甲烷、三氯甲烷及四氯化碳的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 实验编号 | 实验目的 | T/K | pH | c/10-3mol•L-1 | |
| H2O2 | Fe2+ | ||||
| I | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
| II | 探究温度对降解速率的影响 | ① | ② | ③ | ④ |
| III | ⑤ | 298 | 10 | 6.0 | 0.30 |
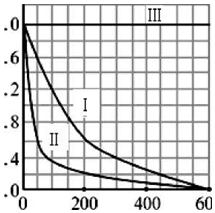
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 molFe和0.1molCu分别与0.1molCl2完全反应,转移的电子数均为0.2NA个 | |
| B. | 4.6g有机物C2H6O的分子结构中含有的C-H键数目一定为0.5NA | |
| C. | 1 mol FeCl3 水解生成的Fe(OH)3胶粒数为NA | |
| D. | 64 g SO2与过量的O2在一定条件下反应生成的SO3分子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com