
| A.稀硫酸和氢氧化钠溶液反应:H++OH-═H2O | ||
B.在硫酸铜溶液中加入氢氧化钡溶液Ba2++S
| ||
| C.金属钠投入水中2Na+2H2O=2Na++2OH-+H2↑ | ||
| D.氯气通入溴化钠溶液中Cl2+2Br-═2Cl-+Br2 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
 I 取一小段镁带,用砂纸除去表面的氧化膜,放入试管中.向试管中加入2mL水,并滴入2滴酚酞试液.一会儿后发现镁带表面有气泡放出,且镁带附近溶液变红色.加热试管至水沸腾.发现镁带表面有大量气泡放出,且试管中的液体全部变为浅红色.关于该试验,下列说法正确的是
I 取一小段镁带,用砂纸除去表面的氧化膜,放入试管中.向试管中加入2mL水,并滴入2滴酚酞试液.一会儿后发现镁带表面有气泡放出,且镁带附近溶液变红色.加热试管至水沸腾.发现镁带表面有大量气泡放出,且试管中的液体全部变为浅红色.关于该试验,下列说法正确的是
 bM(g),M、N的物质的量随时间的变化曲线如右图所示:
bM(g),M、N的物质的量随时间的变化曲线如右图所示:| 1 |
| (t2-t1)×v |
| 1 |
| (t2-t1)×v |
查看答案和解析>>
科目:高中化学 来源: 题型:
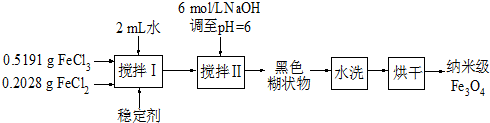
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元 素 | 有关信息 |
| A | 最高价氧化物对应的水化物(甲)能与其气态氢化物(乙)反应生成盐 |
| B | 最外层电子数是次外层电子数的2倍 |
| C | M层上有3个电子 |
| D | 短周期原子半径最大的主族元素 |
| E | 最高正价与最低负价代数和为6 |

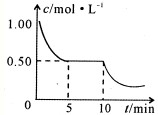
 A2O4(g);△H<0.在恒温恒容条件下,将一定量AO2和A2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示.
A2O4(g);△H<0.在恒温恒容条件下,将一定量AO2和A2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
 研究化学反应原理对于生产、生活及环境保护具有重要意义.
研究化学反应原理对于生产、生活及环境保护具有重要意义.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com