
下列有关气体体积的叙述正确的是( )
-A.-一定温度和压强下,各种气态物质的体积大小,由构成气体的分子大小决定的
-B.-不同的气体,若体积不同,则他们的分子数也不同
-C.-一定温度和压强下,各种气态物质的体积大小,由构成气体的分子数决定的
-D.-气体摩尔体积是指1 mol任何气体所占的体积约为22.4L
考点:-气体摩尔体积.
分析:-A、一定温度和压强下,各种气体物质体积的大小由分子间距离决定;
B、气体体积与温度、压强和气体分子数有关;
C、一定温度和压强下,气体摩尔体积一定,气体的体积有气体的分子数决定;
D、气体摩尔体积的可能数值有无数个.
解答:-解:A、一定温度和压强下,各种气体物质体积的大小由分子间距离决定,故A错误;
B、气体体积与温度、压强和气体分子数有关,当气体所处的状态不相同时,不同气体的气体也可能具有相同的物质的量和分子数,故B错误;
C、气体体积=气体的物质的量×气体摩尔体积,在温度和压强一定的条件下,气体摩尔体积一定,气态物质体积的大小,由构成气体的分子数决定,故C正确;
D、气体摩尔体积是指在某个状态下,1mol气体所占据的体积称为该状态下的气体摩尔体积,气体摩尔体积的可能数值有无数个,只由在标况下,气体摩尔体积才为22.4L/mol,故D错误.
故选C.
点评:-本题考查了气体摩尔体积概念分析,要理解影响气体体积的因素和气体摩尔体积的概念,知道在标准状态下的气体摩尔体积,题目难度中等.


科目:高中化学 来源: 题型:
在同温同压下,下列各组热化学方程式中,△H1>△H2的是()
A. 2H2(g)+O2(g)═2H2O(l)△H1;2H2(g)+O2(g)═2H2O(g)△H2
B. S(g)+O2(g)═SO2(g)△H1;S(s)+O2(g)═SO2(g)△H2
C. C(s)+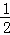 O2(g)═CO(g)△H1;C(s)+O2(g)═CO2(g)△H2
O2(g)═CO(g)△H1;C(s)+O2(g)═CO2(g)△H2
D. H2(g)+Cl2(g)═2HCl(g)△H1;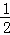 H2(g)+
H2(g)+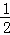 Cl2(g)═HCl(g)△H2
Cl2(g)═HCl(g)△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
三草酸合铁酸钾(K3[Fe(C2O4)3]•xH2O)是一种光敏材料,110℃时失去全部结晶水.
完成下列填空:
某实验小组为测定该晶体中铁的含量和结晶水的含量,做了如下实验:
(一)铁含量的测定
步骤一:称量5.00g三草酸合铁酸钾晶体,配制成250mL溶液.
步骤二:取所配溶液25.00mL 于锥形瓶中,加H2SO4酸化,滴加KMnO4溶液将草酸根恰好全部氧化成CO2,MnO4﹣同时被还原为Mn2+.向反应后的溶液中加入锌粉,加热至黄色刚好消失,过滤并洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶液仍呈酸性.
步骤三:用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02mL,滴定中MnO4﹣被还原成Mn2+.
重复步骤二和步骤三操作,滴定消耗0.010mol/L KMnO4溶液19.98mL.
(1)配制三草酸合铁酸钾溶液的操作步骤依次是:称量、溶解、冷却、转移、洗涤并转移、 、摇匀.
(2)加入锌粉的目的是 .
(3)写出步骤三中发生反应的离子方程式 .
(4)实验测得该晶体中铁的质量分数为 .在步骤二中,若滴加的KMnO4溶液的量不够,则测得的铁含量 .(选填“偏低”、“偏高”或“不变”)
(二)结晶水的测定
将坩埚洗净,烘干至恒重,记录质量;在坩埚中加入研细的三草酸合铁酸钾晶体,称量并记录质量;加热至110℃,恒温一段时间,置于空气中冷却,称量并记录质量;计算结晶水含量.
(5)请纠正上述实验过程中的两处错误: .
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求完成下列问题:
(1)在25℃、101kPa下,1g甲醇(液体,分子式为CH3OH)燃烧生成CO2和液态水时放热22.68kJ.则表示甲醇燃烧热的热化学方程式为 ;将该反应设计成碱性燃料电池,写出该电池的负极电极反应方程式
(2)氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
已知:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.2kJ•mol﹣1
CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=﹣247.4kJ•mol﹣1
以甲烷为原料制取氢气是工业上常用的制氢方法.CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为 .
(3)已知白磷、红磷燃烧的热化学方程式分别为:
P4(s,白磷)+5O2=P4O10(s);△H=﹣2986kJ•mol﹣1
4P(s,红磷)+5O2=P4O10(s);△H=﹣2956kJ•mol﹣1
则白磷比红磷 (填“稳定”或“不稳定”)
(4)已知一定条件下A2与B2自发反应生成AB3,则反应A2(g)+3B2(g)=2AB3(g) 的△S= 0,△H 0 (填“<”、“>”、“=”)
(5)如图为电解精炼银的示意图, a (填a或b)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为 .
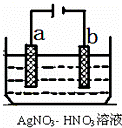
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关气体摩尔体积的描述中正确的是( )
-A.-相同条件下,气体物质的量越大,气体摩尔体积越大
-B.-通常状况下的气体摩尔体积大于22.4L/mol
-C.-非标准状况下的气体摩尔体积不可能为22.4L/mol
-D.-在标准状况下,混合气体的气体摩尔体积比22.4L/mol大
查看答案和解析>>
科目:高中化学 来源: 题型:
化学是一门以实验为基础的自然科学,化学实验在化学学习中具有极其重要的作用.下列实验中所选用的仪器最合理的是( )
①用50mL量筒量取35.20 mL稀硫酸
②用分液漏斗分离苯和四氯化碳的混合物
③用托盘天平称量11.7g氯化钠晶体
④100mL用容量瓶量取100mL稀盐酸
⑤在蒸发皿中锻炼石灰石
⑥用250mL容量瓶配制250mL 0.2mol•L﹣1的NaOH溶液.
-A.-①②④-B.-③⑥-C.-③④⑥-D.-③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)147gH2SO4中含 mol原子,与 g CO2所含有的氧原子数相同.
标准状况下,2.4g某气体的体积为672mL,则此气体的相对分子质量为 .
(3)在标准状况下,V L氨气溶于1L水中,所得溶液的密度为ρg•cm﹣3,溶液的质量分数为ω.则此溶液的物质的量浓度为: 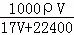 或
或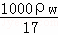 mol/L
mol/L
(4)将Wg胆矾(CuSO4 •5H2O )溶解在VmL水中,得到饱和溶液,测得该饱和溶液的密度为ρg/cm3,则溶液的物质的量浓度为 mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)现有1mol/L CaCl2溶液0.5L,Cl﹣的物质的量浓度为 mol/L.
(2)标准状况下,33.6L的HCl所具有的物质的量为 mol,将其溶解于水配成3L的溶液,所得盐酸的物质的量浓度为 mol/L.
(3)8gNaOH溶于 g水中,才能使每10个水分子中溶有一个钠离子.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com