
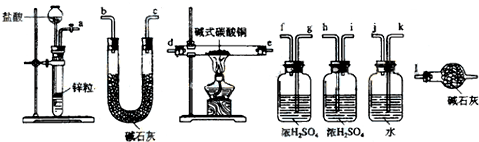
分析 采用氢气还原法测定,利用装置制备氢气,用干燥的氢气与碱式碳酸铜反应,通过测定生成的二氧化碳和水以及反应后固体的质量来确定物质的组成,为防止空气中CO2和H2O进入U型干燥装置,可在最后再连接一个盛有碱石灰的干燥装置来吸收空气中的二氧化碳和水;
(1)本实验的原理,用干燥的氢气与碱式碳酸铜反应,通过测定生成的二氧化碳和水以及反应后固体的质量来确定物质的组成,为防止空气中CO2和H2O进入U型干燥装置,可在最后再连接一个盛有碱石灰的干燥装置来吸收空气中的二氧化碳和水;
(2)装置图中仪器形状和用途可知用于装盐酸的仪器名称为长颈漏斗;
(3)浓硫酸在通入硬质玻璃管前是干燥氢气,在玻璃管后是吸收生成水蒸气,测定水的质量;
(4)根据化学方程式生成物之间的质量关系求出x、y、z,根据生成的水和反应物中水的关系求解水的质量;
(5)若没有装置l,还原产物通过浓硫酸后通过碱石灰,会吸收空气中二氧化碳和水蒸气测定二氧化碳质量增大;
解答 解:(1)本实验的原理,用干燥的氢气融入与碱式碳酸铜反应,通过测定生成的二氧化碳和水以及反应后固体的质量来确定物质的组成,为防止空气中CO2和H2O进入U型干燥装置,可在最后再连接一个盛有碱石灰的干燥装置来吸收空气中的二氧化碳和水;氢气流方向的连接顺序是a→kj→gf→de→hi→bc→l,
故答案为:kj→gf→de→hi→bc;
(2)装置图中仪器形状和用途可知用于装盐酸的仪器名称为长颈漏斗,故答案为:长颈漏斗;
(3)浓硫酸在通入硬质玻璃管前是干燥氢气,在玻璃管后是吸收生成水蒸气,测定水的质量,
故答案为:吸收氢气中的水蒸气;吸收氢气还原碱式碳酸铜反应生成的水蒸气;
(4)xCuCO3•yCu(OH)2•zH2O+( x+y)H2=(x+y)Cu+xCO2↑+(x+2y+z)H2O
64(x+y) 44x 18(x+2y+z)
12.7g 4.4g 7.2g
$\frac{64(x+y)}{12.7g}$=$\frac{44x}{4.4g}$$\frac{44x}{4.4g}$=$\frac{18(x+2y+z)}{7.2g}$
解得:y=x
$\frac{44x}{4.4g}$=$\frac{18(x+2y+z)}{7.2g}$
解得:z=x
令x=1,则y=1,z=1,则化学式为CuCO3•Cu(OH)2•H2O,
故答案为:CuCO3•Cu(OH)2•H2O;
(5)若没有装置l,会影响测定生成二氧化碳的质量,还原产物通过浓硫酸后通过碱石灰,会吸收空气中二氧化碳和水蒸气,使测定二氧化碳质量增大,
故答案为:碱石灰吸收空气中的水蒸气和二氧化碳质量增大,导致测定还原生成的二氧化碳质量增大;
点评 本题考查了物质组成的实验探究,主要是实验原理的分析判断、实验过程、实验中测定产物的实验方法及其化学方程式计算,提炼题干信息,掌握实验基本操作是解题关键,题目难度中等.


科目:高中化学 来源:2016-2017学年山东省高二上10月月考化学卷(解析版) 题型:选择题
如图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色。下列说法正确的是
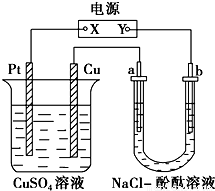
①X是正极,Y是负极 ②a是阴极,b是阳极
③CuSO4溶液的pH值逐渐减小 ④NaCl溶液的pH减小
A.①③ B.②③ C.①④ D.②④
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省高一上10月月考化学卷(解析版) 题型:实验题
现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-和NO3-的相互分离。相应的实验过程可用下图表示:
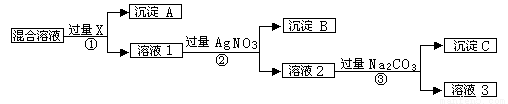
请回答下列问题:
(1)上述实验流程中①②③充分反应后进行物质的分离操作时所需玻璃仪器有 ;
(2)上述实验流程中试剂X为 ,溶液3所含溶质 (均用化学式表示);
(3)上述实验流程中加入过量的Na2CO3的目的是 。
(4)写出上述流程各步所涉及到的化学方程式:
① ②
(5)简述检验溶液1中是否含有SO42-实验操作方法 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省高一上10月月考化学卷(解析版) 题型:选择题
用NA表示阿伏伽德罗常数的数值,下列说法中正确的是
A.5.6g铁与足量盐酸反应生成H2的体积为2.24L
B.32g臭氧(O3)含的原子数目为3NA
C.标准状况下,11.2LCCl4所含的原子数目为1.5NA
D.常温常压下,46gNO2和N2O4混合气体所含的原子数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 纯碱溶液显碱性:CO32-+2H2O?H2CO3+2OH- | |
| B. | 醋酸溶液显酸性:CH3COOH+H2O?CH3COO-+H3O+ | |
| C. | 向碘化亚铁溶液中通入足量的溴水:3Br2+2Fe2++4I-═6Br-+2Fe3++2I2 | |
| D. | 向碳酸氢钙溶液中滴加过量的烧碱溶液:HCO3-+Ca2++2OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
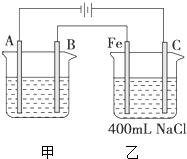 如图所示为相互串联的甲、乙两电解池.试回答:
如图所示为相互串联的甲、乙两电解池.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解水生成氢气和氧气时,电能转化为化学能 | |
| B. | 煤燃烧时,化学能主要转化为热能 | |
| C. | 绿色植物进行光合作用时,太阳能转化为化学能 | |
| D. | 白炽灯工作时,化学能主要转化为光能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com