
| A. | 在1 L 2 mol•L-1的硝酸镁溶液中含有的硝酸根离子数为2NA | |
| B. | 2.3 g Na变成Na+时失去的电子数目为0.2NA | |
| C. | 1 mol H2O的质量与NA个H2O的质量之和相等 | |
| D. | 在通常状况下,22.4 L O2与N2的混合物所含分子数为NA |
分析 A.1mol硝酸镁含有2mol硝酸根离子;
B.钠失去1个电子生成+1价钠离子;
C.依据n=$\frac{N}{NA}$计算解答;
D.通常状况下Vm≠22.4L/mol.
解答 解:A.在1 L 2 mol•L-1的硝酸镁溶液中含有硝酸镁物质的量为2mol,含有的硝酸根离子数为4NA,故A错误;
B.每个Na变为Na+都失去1个电子,则0.1 molNa失去的电子数目为0.1NA,故B错误;
C.NA个H2O的物质的量为$\frac{{N}_{A}}{{N}_{A}}$=1mol,所以1 mol H2O的质量与NA个H2O的质量之和相等,故C正确;
D.通常状况下Vm≠22.4L/mol,22.4 L O2与N2的混合物所含分子数不是1mol,故D错误;
故选:C.
点评 本题考查阿伏加德罗常数,掌握以物质的量为核心的计算公式是解题关键,注意气体摩尔体积使用条件和对象,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1的CH3COOH溶液的pH=2 | B. | CH3COOH溶液中含有CH3COOH分子 | ||
| C. | CH3COOH能与NaOH发生中和反应 | D. | 常温下CH3COONa溶液的pH=8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 连二亚硫酸钠(Na2S2O4)又称保险粉,是印刷工业中重要的还原剂.某课题小组进行如下实验.
连二亚硫酸钠(Na2S2O4)又称保险粉,是印刷工业中重要的还原剂.某课题小组进行如下实验.| 实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
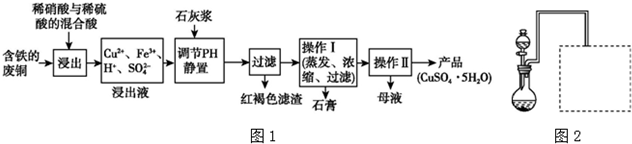
| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶内有水,未经过干燥处理 | |
| B. | 定容时,仰视刻度线 | |
| C. | 用量筒量取浓NaOH溶液时,用水洗涤量筒2~3次,洗涤液倒入烧杯中 | |
| D. | 定容后倒转容量瓶几次,发现液体最低点低于刻度线,再补加几滴水到刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
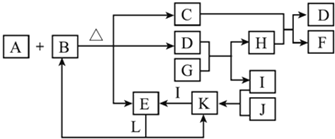
 A、B、C、D、E五种物质(或离子)均含有同一种元素,它们之间有如图所示的转化关系:
A、B、C、D、E五种物质(或离子)均含有同一种元素,它们之间有如图所示的转化关系:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
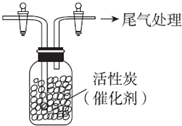 某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.
某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L溶液中含Ba2+、N${O}_{3}^{-}$的总数是0.6NA | |
| B. | 500 mL溶液中Ba2+的浓度是0.2 mol•L-1 | |
| C. | 500 mL溶液中N${O}_{3}^{-}$的浓度是0.2 mol•L-1 | |
| D. | 1 L溶液中含有0.4NA个N${O}_{3}^{-}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com