
分析 (1)电镀是将镀件与电源负极相连、镀层与电源正极相连;
(2)①若用铜盐进行化学镀铜,阴极上铜离子得电子发生氧化反应,所以需要还原剂与之反应;
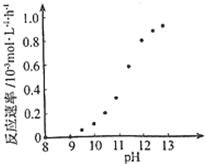
②根据图知,溶液的pH越大反应速率越大,可以通过控制溶液pH控制反应速率;
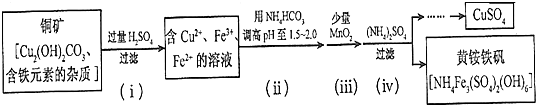
(3)铜矿中加入过量稀硫酸,发生的反应有Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2↑+3H2O,溶液中金属阳离子有Cu2+、Fe2+、Fe3+,溶液呈酸性,加入碳酸氢铵,碳酸氢根离子和氢离子反应生成二氧化碳,从而增大溶液pH;向溶液中加入少量二氧化锰,酸性条件下,二氧化锰和亚铁离子反应生成铁离子、锰离子和水;向溶液中加入硫酸铵,硫酸铵和铁离子反应生成沉淀NH4Fe3(SO4)2(OH)6,采用过滤方法分离沉淀和溶液,然后通过蒸发浓缩、冷却结晶得到硫酸铜晶体,再结合题目分析解答.
解答 解:(1)电镀是将镀件与电源负极相连、镀层与电源正极相连,故答案为:负;
(2)①若用铜盐进行化学镀铜,阴极上铜离子得电子发生氧化反应,所以需要还原剂与之反应,故答案为:还原剂;
②根据图示信息,pH=8-9之间,反应速率为0,所以要使反应停止,调节溶液的pH至8-9 之间,故答案为:调节溶液的pH至8-9 之间;
(3)铜矿中加入过量稀硫酸,发生的反应有Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2↑+3H2O,溶液中金属阳离子有Cu2+、Fe2+、Fe3+,溶液呈酸性,加入碳酸氢铵,碳酸氢根离子和氢离子反应生成二氧化碳,从而增大溶液pH;向溶液中加入少量二氧化锰,酸性条件下,二氧化锰和亚铁离子反应生成铁离子、锰离子和水;向溶液中加入硫酸铵,硫酸铵和铁离子反应生成沉淀NH4Fe3(SO4)2(OH)6,采用过滤方法分离沉淀和溶液,然后通过蒸发浓缩、冷却结晶得到硫酸铜晶体,
①碱式碳酸铜与硫酸反应生成硫酸铜、二氧化碳和水,反应方程式为Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2↑+3H2O,
故答案为:Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2↑+3H2O;
②题目要求调高pH,铵根离子显酸性,碳酸氢根离子显碱性,则起作用的离子是碳酸氢根离子,故答案为;HCO3-;
③依题意亚铁离子变成了铁离子,1mol MnO2转移电子2 mol,则锰元素从+4变成+2价,溶液是显酸性的,方程式经过观察可要补上氢离子,综合上述分析可写出离子方程式为MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,
故答案为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
④滤后母液的pH=2.0,则c(H+)=0.01mol/L,c(Fe3+)=a mol•L-1,c(NH4+)=b mol•L-1,c(SO42-)=d mol•L-1,该反应的平衡常数K=$\frac{{c}^{6}({H}^{+})}{{c}^{3}(F{e}^{3+}).c(N{{H}_{4}}^{+}).{c}^{2}(S{{O}_{4}}^{2-})}$=$\frac{(0.01)^{6}}{{a}^{3}×b×{d}^{2}}$=$\frac{1{0}^{-12}}{{a}^{3}b{d}^{2}}$,
故答案为:$\frac{1{0}^{-12}}{{a}^{3}b{d}^{2}}$.
点评 本题考查物质分离和提纯的综合应用及电解原理,侧重考查学生分析能力,明确流程图中发生的反应及分离方法是解本题关键,熟悉元素化合物性质及基本原理,难点是二氧化锰和亚铁离子反应方程式的书写,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯乙烷与NaOH溶液共热,在水解后的溶液中加入硫酸,再加入AgNO3溶液检验Cl- | |
| B. | 将电石和水反应后的气体通入溴水中,如果溴水褪色,证明乙炔和溴发生了反应 | |
| C. | 实验室制溴苯时,将苯与液溴混合后加到有铁丝的反应容器中 | |
| D. | 向苯酚浓溶液中滴入少量浓溴水可观察到白色三溴苯酚沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
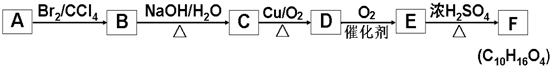
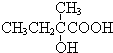
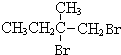 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$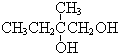 +2NaBr,反应类型取代反应
+2NaBr,反应类型取代反应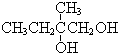 +O2+O2$\stackrel{催化剂}{→}$2
+O2+O2$\stackrel{催化剂}{→}$2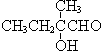 +2H2O,反应类型氧化反应
+2H2O,反应类型氧化反应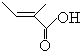 、
、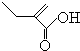 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3-CH2-COOH | B. | CH2=CH-CH2-OH | C. | CH2=CH-COOH | D. | CH2=CH-COOCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:HCl>HI | B. | 原子半径:Na>Mg | ||
| C. | 酸性:H2SO4>H2SO3 | D. | 结合质子能力:Cl->S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 事实 | 推测 | |
| A | Mg与水反应缓慢,Ca与水反应较快 | Ba与水反应会更快 |
| B | Si是半导体材料,同族Ge也是半导体材料 | ⅣA族的元素都是半导体材料, |
| C | HCl在1500℃时分解,HI在230℃时分解 | HBr的分解温度介于二者之间 |
| D | Si与H2高温时反应,S与H2加热能反应 | P与H2在高温时能反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新戊烷与氯气在光照条件下的取代反应 | |
| B. | 乙烯与水在一定条件下的加成反应 | |
| C. | 乙醇在空气中加热(以铜作为催化剂)的氧化反应 | |
| D. | 苯与足量的氢气在一定条件下的加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com