
H3PO2也可用电渗析法制备。“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
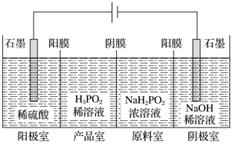
①写出阳极的电极反应式______________________________________________。
②分析产品室可得到H3PO2的原因__________________________________________
________________________________________________________________________。
③早期采用“三室电渗析法”制备H3PO2:将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替。并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室。其缺点是产品中混有____________杂质。该杂质产生的原因是________________________________。
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
实验室用KClO3和浓盐酸反应也可以制备氯气。某研究性学习小组利用如图所示装置在实验室中制取Cl2并探究其相关性质:
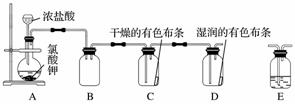
(1)装置A中存在一处错误,请改正这处错误:________________________。
(2)写出装置A中发生反应的化学方程式:________________________________________________________________________
________________________________________________________________________。
(3)为了除去氯气中的氯化氢,需要在装置A、B之间添加装置E,装置E中所盛装的试剂为________________。为了探究使有色布条褪色的是氯气还是氯气与水反应的生成物,需要在整套装置中添加装置E,其中加入浓硫酸,装置E在整套装置中的添加位置为________(填字母)。
a.A、B之间 b.B、C之间
c.C、D之间 d.D之后
(4)取下集气瓶B,将铁丝加热至红热状态,伸入集气瓶B中,可以观察到的现象是______________________,能检验该反应产物中铁元素价态的试剂是________(填字母)。
a.氯水 b.蒸馏水和铁粉
c.氢氧化钠溶液 d.KSCN溶液
(5)另外一个化学学习小组就环境保护方面指出了上述装置的缺陷,并给出了改进措施,该改进措施是________________________________________________________________________
__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用惰性电极电解饱和Na2SO4溶液,一段时间后,析出w g Na2SO4·10 H2O晶体,阴极上放出a g气体,则饱和Na2SO4溶液的质量分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在如图所示的装置中,若通直流电5 min时,铜电极质量增加2.16 g。试回答下列问题。
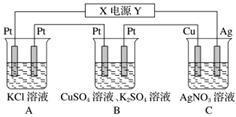
(1)电源中X电极为直流电源的________极。
(2)pH变化:A:________,B:________,C:________(填“增大”、“减小”或“不变”)。
(3)通电5 min时,B中共收集224 mL(标准状况下)气体,溶液体积为200 mL,则通电前CuSO4溶液的物质的量浓度为________(设电解前后溶液体积无变化)。
(4)若A中KCl足量且溶液的体积也是200 mL,电解后,溶液的pH为__________(设电解前后溶液体积无变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学组装了如图所示的电化学装置,电极Ⅰ为Al,其他均为Cu,则( )
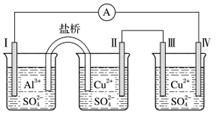
A.电流方向:电极Ⅳ→A→电极Ⅰ
B.电极Ⅰ发生还原反应
C.电极Ⅱ逐渐溶解
D.电极Ⅲ的电极反应:Cu2++2e-===Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
有关金属的腐蚀与防护的叙述正确的是( )
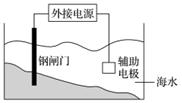
A.金属的化学腐蚀比电化学腐蚀普遍
B.上图装置的原理是“牺牲阳极的阴极保护法”
C.金属腐蚀的本质是M-ne-===Mn+而被损耗
D.用铝质铆钉来接铁板,铁板易被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
截至到2013年12月末,中国光伏发电新增装机容量达到10.66 GW,光伏发电累计装机容量达到17.16 GW,图为利用光伏并网发电装置电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。
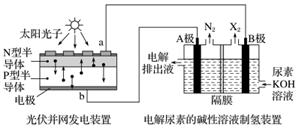
下列叙述中正确的是( )
A.N型半导体为正极,P型半导体为负极
B.制氢装置溶液中电子流向:从B极流向A极
C.X2为氢气
D.工作时,A极的电极反应式为CO(NH2)2+8OH--6e-===CO +N2↑+6H2O
+N2↑+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
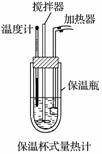
在量热计(如图)中将100 mL 0.50 mol·L-1的CH3COOH溶液与100 mL 0.55 mol·L-1 NaOH溶液混合,温度从298.0 K升高到300.7 K。已知量热计的热容常数(量热计各部件每升高1 K所需要的热量)是150.5 J·K-1,溶液密度均为1 g·mL-1,生成溶液的比热容c=4.184 J·g-1·K-1(已知CH3COOH电离要吸热)。
(1)CH3COOH的中和热ΔH=_____________________________________________。
(2)CH3COOH中和热的文献值为-56.1 kJ·mol-1,你认为造成(1)中测得的实验值有偏差的可能原因是_______________________________________________________________________。
(3)实验中NaOH溶液过量的目的是_______________________________________________。
(4)你认为CH3COOH的中和热与盐酸的中和热绝对值相比,__________的较大,其原因是________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com