
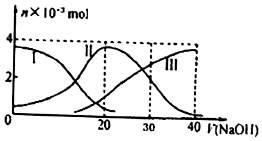
| A. | H2A在水中的电离方程式是:H2A═H++HA-、HA-?H++A2- | |
| B. | 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 | |
| C. | 当V(NaOH)=30 mL时,溶液中存在以下关系:2c(H+ )+c(HA- )+2c(H2A)═c(A2- )+2c(OH-) | |
| D. | 当V(NaOH)=20 mL时,溶液中各粒子浓度的大小顺序为c(Na+)>c(HA-)>c(H+)>c(OH-) |
分析 A.根据图知,加入NaOH溶液过程中含有A元素的微粒有三种,说明H2A是二元弱酸,H2A存在两步电离平衡;
B.等体积等浓度的NaOH溶液与H2A溶液混合后,二者恰好完全反应生成NaHA,NaHA溶液中c(H2A)<c(A2- ),说明HA-电离程度大于其水解程度,其水溶液呈酸性;
C.当V(NaOH)=30 mL时,溶液中溶质为等物质的量浓度的Na2A和NaHA,溶液中存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断;
D.当V(NaOH)=20 mL时,二者恰好完全反应生成NaHA,NaHA溶液中c(H2A)<c(A2- ),说明HA-电离程度大于其水解程度,其水溶液呈酸性,结合电荷守恒判断离子浓度大小.
解答 解:A.根据图知,加入NaOH溶液过程中含有A元素的微粒有三种,说明H2A是二元弱酸,H2A存在两步电离平衡,所以其电离方程式为H2A?H++HA-、HA-?H++A2-,故A错误;
B.等体积等浓度的NaOH溶液与H2A溶液混合后,二者恰好完全反应生成NaHA,NaHA溶液中c(H2A)<c(A2- ),说明HA-电离程度大于其水解程度,其水溶液呈酸性,则水的电离程度小于纯水的电离程度,故B错误;
C.当V(NaOH)=30 mL时,溶液中溶质为等物质的量浓度的Na2A和NaHA,溶液中存在电荷守恒和物料守恒,根据电荷守恒得c(H+ )+c(Na+)=c(HA- )+2c(A2- )+c(OH-),
物料守恒为2c(Na+)=3c(HA- )+3c(H2A)+3c(A2- ),
所以得2c(H+ )+c(HA- )+3c(H2A)=c(A2- )+2c(OH-),
故C错误;
D.当V(NaOH)=20 mL时,二者恰好完全反应生成NaHA,NaHA溶液中c(H2A)<c(A2- ),说明HA-电离程度大于其水解程度,其水溶液呈酸性,酸式酸根离子离子水解和电离但其程度都较小,钠离子不水解,所以离子浓度大小顺序是c(Na+)>c(HA-)>c(H+)>c(OH-),故D正确;
故选D.
点评 本题考查酸碱混合溶液定性判断,为高频考点,侧重考查学生图象分析、判断能力,明确各点溶液中溶质成分及其相对大小是解本题关键,易错选项是B,注意:含有弱离子的盐不一定促进水电离.


 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:选择题
| A. | N2$→_{高温、高压、催化剂}^{H_{2}}$NH3$\stackrel{HCl(aq)}{→}$NH4Cl(aq) | |
| B. | AgNO3$\stackrel{NH_{3}•H_{2}O}{→}$[Ag(NH3)2]OH(aq)$→_{△}^{蔗糖}$ Ag | |
| C. | SiO2$\stackrel{HCl(aq)}{→}$SiCl4$→_{高温}^{H_{2}}$Si | |
| D. | MgCO3$\stackrel{HCl(aq)}{→}$MgCl2(aq)$\stackrel{电解}{→}$ Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一个D216O分子所含的中子数为8 | |
| B. | NH4Cl是只含非金属元素的共价化合物 | |
| C. | HCl的电子式为 | |
| D. | H2S不如HF稳定性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2分子中只存在极性键 | B. | NH3的结构式为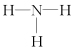 | ||
| C. | HCl的电子式为 | D. | 每个水分子内含有2个氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HSO3与NaOH等物质的量反应:NH4++HSO3-+2OH-═NH3•H2O+SO32- | |
| B. | 铜与浓硝酸反应的离子方程式为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| C. | 1.0 mol•L-1的KNO3溶液中可大量存在H+、Fe2+、Cl-、SO42- | |
| D. | 过量SO2通入次氯酸钠溶液:SO2+ClO-+H2O═SO42-+Cl-+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素Y的最高正化合价为+6 | |
| B. | 离子半径的大小顺序为W>Q>Z>X>Y | |
| C. | 常温下,1molQ单质和足量的NaOH溶液反应转移1mol电子 | |
| D. | 元素W的最高价氧化物对应的水化物酸性比Q的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 反应类型加聚反应
反应类型加聚反应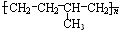 单体结构简式为CH2=CH2和CH3-CH=CH2.
单体结构简式为CH2=CH2和CH3-CH=CH2.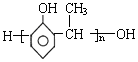 单体结构简式为
单体结构简式为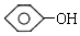 和CH3CHO.
和CH3CHO.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
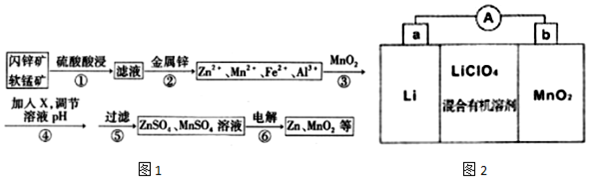
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,2-二甲基丁烷与2,4-二甲基戊烷的一氯代物数目不相同 | |
| B. | 乙烷,苯,葡萄糖溶液均不能使酸性高锰酸钾溶液褪色 | |
| C. | 苯的密度比水小,但由苯反应制得的溴苯、硝基苯、环己烷的密度都比水大 | |
| D. | 与环己醇(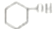 )互为同分异构体、且含有醛基(-CHO)的结构有8种(不含立体结构) )互为同分异构体、且含有醛基(-CHO)的结构有8种(不含立体结构) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com