用NA表示阿伏加德罗常数.下列说法中正确的是( )
A.1.8g重水(D2O)中含有的质子数为1.0NA
B.500℃、30MPa下:N2(g)+3H2(g)?2NH3(g);△H=-38.6kJ?mol-1;将1.5NA的H2和过量N2在此条件下充分反应,放出热量19.3kJ
C.标准状况下,11.2LCl2通入足量的冷的石灰乳中制备漂白粉,转移的电子数为0.5NA
D.60g石英晶体中含有的Si-O键数目为2NA(Si的相对原子质量:28)
【答案】
分析:A、依据质量换算物质的量结合分子式计算;
B、依据反应是可逆反应不可能进行彻底;
C、依据氯气和氢氧化钙反应是氯气自身的氧化还原反应计算电子转移数;
D、依据二氧化硅的结构判断,1mmol二氧化硅中含有4molSi-O键分析.
解答:解:A、1.8g重水物质的量为
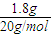
=0.09mol,含质子数为0.09mol×10=0.9mol,故A错误;
B、将1.5N
A的H
2和过量N
2在此条件下充分反应,因为反应是可逆反应,不可能进行完全,所以放出热量小于19.3kJ,故B错误;
C、标准状况下,11.2LCl
2物质的量为0.5mol,通入足量的冷的石灰乳中制备漂白粉发生的是氯气的自身氧化还原反应,1molCl
2反应转移电子为1mol,所以0.5mol氯气反应转移电子0.5mol,故C正确;
D、60g石英晶体物质的量为1mol,含有Si-O键数目为4N
A,故D错误;
故选C.
点评:本题考查了阿伏伽德罗常数的应用,主要考查质量换算物质的量来计算微粒数,可逆反应的应用,气体摩尔体积的条件应用,氧化还原反应的电子转移计算,二氧化硅的结构分析.

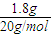 =0.09mol,含质子数为0.09mol×10=0.9mol,故A错误;
=0.09mol,含质子数为0.09mol×10=0.9mol,故A错误;

 阅读快车系列答案
阅读快车系列答案