
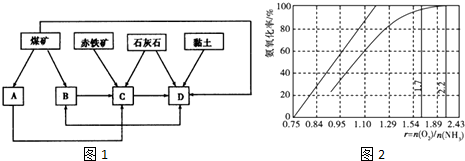
分析 (1)①煤炭燃烧可以发电,煤的干馏制造煤焦油,赤铁矿、碳酸钙是炼铁的原料,碳酸钙和黏土是生产水泥的原料;
②高炉炼铁中得到生铁的方程式为Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2、CaCO3+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑;
(2)①反应物投入的物质的量越多放出的热越多;
②玻璃钢是将玻璃纤维和高分子材料复合而成的复合材料,其中玻璃纤维的作用是增强体,合成材料是基体,它的优点有:强度高、质量轻、耐腐蚀、抗冲击、绝缘性能好等;
③废旧合成材料的再生利用主要有三条途径:通过再生和改性,重新做成多种有用的材料和制品;采用热裂解或化学处理方法使其分解,用于制备多种化工原料;将废旧的聚合物作为燃料回收利用热能;
(3)根据氨氧化的化学方程式来分析;根据O2浓度太少不利于NH3的转化分析.
解答 解:(1)①煤炭燃烧可以发电,A为发电厂,煤的干馏制造煤焦油,B为焦化厂,赤铁矿、碳酸钙是炼铁的原料,C为炼铁厂,碳酸钙和黏土是生产水泥的原料,D为水泥厂,
故答案为:发电厂;焦化厂;炼铁厂;水泥厂;
②高炉炼铁中得到生铁的方程式为Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,产生炉渣的方程式为CaCO3+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑,
故答案为:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2、CaCO3+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑;
(2)①苯酚和甲醛发生缩聚反应,反应有大量热放出,为防止温度过高,应向已有苯酚的反应釜中间歇性的加入甲醛,并装有散热装置,
故答案为:间歇性;散热;
②玻璃钢是将玻璃纤维和高分子材料复合而成的复合材料,其中玻璃纤维的作用是增强体,合成材料是基体,它的优点有:强度高、质量轻、耐腐蚀、抗冲击、绝缘性能好等,
故答案为:增强体;强度高、质量轻、耐腐蚀、抗冲击、绝缘性能好;
③废旧合成材料的再生利用主要有三条途径:通过再生和改性,重新做成多种有用的材料和制品;采用热裂解或化学处理方法使其分解,用于制备多种化工原料;将废旧的聚合物作为燃料回收利用热能,塑料深埋很久不会腐烂,会造成白色污染,酚醛塑料不能溶于有机溶剂,
故答案为:bc;
(3)由氨氧化的化学方程式:4NH3+5O2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$4NO+6H2O,可知氨氧化率达到100%,理论上r{n(O2)/n(NH3)}=$\frac{5}{4}$=1.25,O2浓度太少不利于NH3的转化,γ{n(O2)/n(NH3)值为2.2时NH3氧化率已近100%,
故答案为:1.25;O2太少不利于NH3的转化,r值为2.2时NH3氧化率已近100%.
点评 本题考查了新型有机高分子材料、转化率随温度、压强的变化曲线、金属冶炼、氧化还原方程式的书写的相关知识,题目难度中等,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及化学实验能力.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:选择题
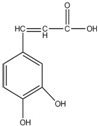
| A. | 该有机物属于烃类 | |
| B. | 与溴水既能发生取代反应,又能发生加成反应 | |
| C. | 1mol咖啡酸最多可与5mol氢气发生加成反应 | |
| D. | 能与Na2CO3溶液反应,但不能与NaHCO3溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫化亚铁溶于稀硝酸中:FeS+2H+═Fe2++H2S↑ | |
| B. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O | |
| C. | 用催化法处理汽车尾气中的CO和NO:CO+NO$\stackrel{催化剂}{→}$C+NO2 | |
| D. | 大理石溶于醋酸中:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
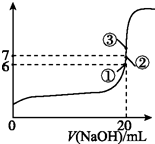 电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如下表所示:
电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如下表所示:| 化学式 | HF | H2CO3 | HClO |
| 电离平衡常数(Ka) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 日常生活中常用无水乙醇做消毒剂 | |
| B. | 乙烯和苯都可以发生加成反应,都可以通过石油分馏得到 | |
| C. | 等物质的量的乙烯和乙醇完全燃烧时消耗氧气的质量相等 | |
| D. | 糖类、油脂、蛋白质都可以水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硼和氮元素在化学中有很重要的地位,回答下列问题:
硼和氮元素在化学中有很重要的地位,回答下列问题: .预计于2017年发射的“嫦娥五号”探测器采用的长征5号运载火箭燃料为偏二甲肼[(CH3)2NNH2].(CH3)2NNH2中N原子的杂化方式为sp3.
.预计于2017年发射的“嫦娥五号”探测器采用的长征5号运载火箭燃料为偏二甲肼[(CH3)2NNH2].(CH3)2NNH2中N原子的杂化方式为sp3.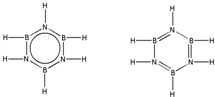 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
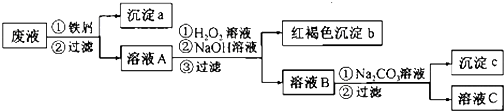
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2>CsCl>CBr4>CF4 | B. | CF4>CCl4>CBr4>Cl4 | ||
| C. | 金刚石>晶体硅>二氧化硅>碳化硅 | D. | NaF>MgF2>AlF3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com