
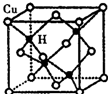
 科学研究表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)
科学研究表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO) .
.分析 (1)①Mn的原子序数为25,根据能量最低原理可写出Mn的基态原子的电子排布式,进而可确定Mn2+基态的电子排布式;
②利用价层电子对互斥模型判断;
(2)①根据N2与CO为等电子体,结合等电子体结构相似判断;
②根据价层电子对互斥理论确定中心原子杂化方式,根据空间构型可判断键角的大小;
③HCHO分子中含有2个C-H键、1个C=O双键,分子中含有3个σ键;
(3)②距离中心Si最近的第一层的4个C原子,每一个又连接着另外3个Si原子,这12个Si原子平均分布在一个球面上,根据直角三角形计算正四面体的边长;
(4)[Cu(OH)4]2-中与Cu2+与4个OH-形成配位键;
(5)利用均摊法计算该晶胞中含有的铜原子和氢原子个数,再根据质量、密度和体积之间的关系式 $\frac{m}{V}$计算.
解答 解:(1)①Mn的原子序数为25,基态原子的电子排布式为,1s22s22p63s23p63d54s2,则Mn2+基态的电子排布式可表示为1s22s22p63s23p63d5(或[Ar]3d5),故答案为:1s22s22p63s23p63d5(或[Ar]3d5);
②NO3-中N原子形成3个δ键,没有孤电子对,则应为平面三角形,故答案为:平面三角形;
(2)①N2与CO为等电子体,二者结构相似,N2的结构为N≡N,则CO的结构为C≡O,故答案为:C≡O;
②甲醛中C原子形成3个σ键,没有孤电子对,碳原子的杂化为sp2杂化,是平面三角形结构,键角为120°,甲醇分子内碳原子形成4个σ键,无孤电子对,杂化方式为sp3杂化,是四面体结构,O-C-H键角约为109°28′,键角小于120°,所以甲醇分子内O-C-H键角比甲醛分子内O-C-H键角小,
故答案为:sp3;小于;
③HCHO分子中含有2个C-H键、1个C=O双键,分子中含有3个σ键,1mol甲醛(HCHO)分子中含有的σ键数目为3×6.02×1023,
故答案为:3×6.02×1023;
(3)距离中心Si最近的第一层的4个C原子,每一个又连接着另外3个Si原子,这12个Si原子平均分布在一个球面上,F是C原子,A、B、C、D分别代表一个Si原子,AB、AC、AD、BC、BD、CD的边长相等,AF、BF的长相等为d,F位于体心上,O位于正三角形BCD的重心上,在正三角形BCD中,BE为三角形BCD的高,则CE为BC的一半,如图 ,设正四面体的边长为x,CE的长为0.5x,BE=$\sqrt{x{\;}^{2}-(0.5x){\;}^{2}}$=$\frac{\sqrt{3}}{2}$x,BO与OE的长之比为2:1,则BO的长为$\frac{\sqrt{3}}{2}$x×$\frac{2}{3}$=$\frac{\sqrt{3}}{3}$x,在三角形ABO中,AO的长=$\sqrt{{x}^{2}-({\frac{\sqrt{3}}{3}x)}^{2}}$=$\frac{\sqrt{6}}{3}$x,在三角形BFO中,OF的长=$\frac{\sqrt{6}}{3}$x-d=$\sqrt{d{\;}^{2}-(\frac{\sqrt{3}}{3}x)^{2}}$,x=$\frac{2\sqrt{6}}{3}d$,
,设正四面体的边长为x,CE的长为0.5x,BE=$\sqrt{x{\;}^{2}-(0.5x){\;}^{2}}$=$\frac{\sqrt{3}}{2}$x,BO与OE的长之比为2:1,则BO的长为$\frac{\sqrt{3}}{2}$x×$\frac{2}{3}$=$\frac{\sqrt{3}}{3}$x,在三角形ABO中,AO的长=$\sqrt{{x}^{2}-({\frac{\sqrt{3}}{3}x)}^{2}}$=$\frac{\sqrt{6}}{3}$x,在三角形BFO中,OF的长=$\frac{\sqrt{6}}{3}$x-d=$\sqrt{d{\;}^{2}-(\frac{\sqrt{3}}{3}x)^{2}}$,x=$\frac{2\sqrt{6}}{3}d$,
故答案为:12; $\frac{2\sqrt{6}}{3}d$;
(4)[Cu(OH)4]2-中与Cu2+与4个OH-形成配位键,可表示为 ,
,
故答案为: ;
;
(5)该晶胞中含有4个H原子,铜原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,所以该晶胞中含有4个铜原子4个氢原子,设该晶胞的边长为a,则d=$\frac{\frac{4×(64+1)}{N{\;}_{A}}}{a{\;}^{3}}$,所以a=$\root{3}{\frac{260}{dN{\;}_{A}}}$cm,
故答案为:$\root{3}{\frac{260}{dN{\;}_{A}}}$.
点评 本题综合考查物质的结构与性质知识,侧重于电子排布式、等电子体、杂化类型与配位键等知识,题目难度中等,注意把握杂化类型的判断方法,晶胞计算 为本题的难点.


科目:高中化学 来源: 题型:填空题
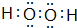 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
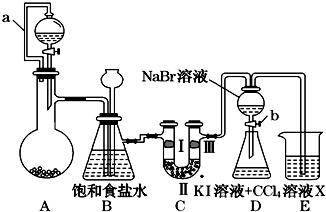
| ① | ② | ③ | ④ | |
| Ⅰ | 湿润的红纸条 | 干燥的红纸条 | 干燥的红纸条 | 湿润的红纸条 |
| Ⅱ | 碱石灰 | 浓硫酸 | 硅胶 | 氯化钠 |
| Ⅲ | 湿润的红纸条 | 干燥的红纸条 | 干燥的白纸条 | 干燥的红纸条 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
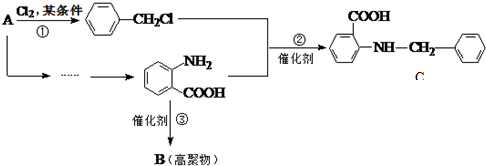
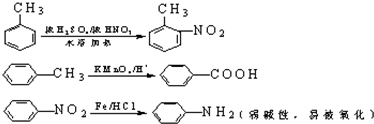
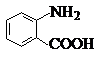 中官能团的名称氨基、羧基.
中官能团的名称氨基、羧基.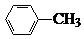 +Cl2$\stackrel{光}{→}$
+Cl2$\stackrel{光}{→}$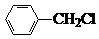 +HCl.
+HCl.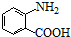 多一个碳的同系物,则满足下列条件的D的同分异构体共有19种,写出一种满足条件且含4种不同氢原子的同分异构体的结构简式
多一个碳的同系物,则满足下列条件的D的同分异构体共有19种,写出一种满足条件且含4种不同氢原子的同分异构体的结构简式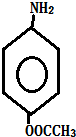 等.
等. .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
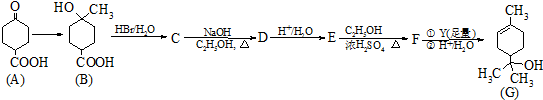
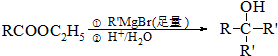
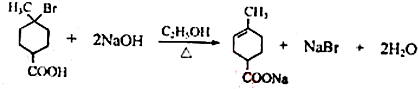 .
.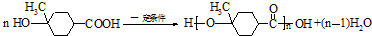 .
.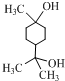 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合溶液中c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-) | |
| B. | 混合溶液中c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-) | |
| C. | 加入AgNO3溶液时首先生成AgCl沉淀 | |
| D. | 混合溶液中$\frac{c(C{l}^{-})}{c({I}^{-})}$约为1.03×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
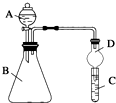 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com