
| A. | 1 mol液态肼在足量氧气中完全燃烧生成水蒸气,放出642 kJ的热量: N2H4(l)+O2(g)═N2(g)+2H2O(g)△H=+642 kJ•mol-1 | |
| B. | 12 g石墨转化为CO时,放出110.5 kJ的热量: 2C(石墨,s)+O2(g)═2CO(g)△H=-110.5 kJ•mol-1 | |
| C. | 已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-286 kJ•mol-1, 则:2H2O(l)═2H2(g)+O2(g)的△H=+572 kJ•mol-1 | |
| D. | 已知N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ•mol-1,则在一定条件下向密闭容器中充入0.5 mol N2(g)和1.5 mol H2(g)充分反应放出46.2 kJ的热量 |
分析 A、放热反应的反应热为负值;
B、12g石墨的物质的量为1mol;
C、根据盖斯定律来分析;
D、合成氨的反应为可逆反应,不能进行彻底.
解答 解:A、放热反应的反应热为负值,故A错误;
B、12g石墨的物质的量为1mol,故热化学方程式应为:2C(石墨,s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,故B错误;
C、根据盖斯定律可知:反应热与计量数成正比,且氢气的燃烧放热,则水的分解为吸热,故C正确;
D、合成氨的反应为可逆反应,不能进行彻底,故在一定条件下向密闭容器中充入 0.5 mol N2(g)和1.5 mol H2(g)充分反应放出的热量小于46.2 kJ,故D错误.
故选C.
点评 本题考查了热化学方程式的书写,应注意反应热与计量数成比例,且放热反应的反应热为负值,吸热反应的反应热为正值.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热化学方程式中的化学计量数表示物质的量,可以是分数 | |
| B. | △H>0表示放热反应,△H<0表示吸热反应 | |
| C. | 酸碱中和时放出的热叫做中和热 | |
| D. | 1mol H2与0.5 mol O2反应放出的热就是H2的燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开始时A容器中的反应速率大于B容器中的反应速率 | |
| B. | 平衡时c(I2)A=c(I2)B | |
| C. | HI的平衡分解率:αA>αB | |
| D. | 平衡时,I2蒸气在混合气体中的体积分数:A容器>B容器 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3OH (l)+$\frac{3}{2}$O2 (g)═CO2(g)+2H2O(l)△H=+726.5 kJ/mol | |
| B. | 2CH3OH (l)+3O2 (g)═2CO2(g)+4H2O(g)△H=+1453 kJ/mol | |
| C. | CH3OH (l)+$\frac{3}{2}$O2 (g)═CO2(g)+2H2O(l)△H=-726.5 kJ/mol | |
| D. | 2CH3OH (l)+3O2 (g)═2CO2(g)+4H2O(g)△H=-1453 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Fe | H2O(g) | Fe3O4 | H2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
| Fe | H2O(g) | Fe3O4 | H2 | |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1 | 4 |
| C/mol | m | n | p | q |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 有一种甲醇质子交换膜燃料电池,电池的结构示意图如图,则下列有关说法不正确的是( )
有一种甲醇质子交换膜燃料电池,电池的结构示意图如图,则下列有关说法不正确的是( )| A. | 电极c是电池的负极 | |
| B. | 每消耗1mol甲醇转移的电子数为3NA | |
| C. | 电极d的反应式为:4H++O2+4e-=2H2O | |
| D. | 电极c的反应式为:CH3OH+H2O-6e-=CO2+6H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
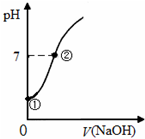 常温下,向饱和氯水中逐滴滴入0.1mol•L-1的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )
常温下,向饱和氯水中逐滴滴入0.1mol•L-1的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )| A. | ①点所示溶液中只存在HClO的电离平衡 | |
| B. | ①到②水的电离程度逐渐减小 | |
| C. | I-能在②点所示溶液中存在 | |
| D. | ②点所示溶液中:c(Na+)=c(Cl-)+c(ClO-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com