
 �Ȼ������Ʊ����߷��ӻ����������л��ϳ����й㷺����;�����������գ�
�Ȼ������Ʊ����߷��ӻ����������л��ϳ����й㷺����;�����������գ����� ��1��Al3+��ˮ�⣬ˮ������H+��������Һʱ���ɼ�����������AlCl3ˮ�⣬��ֹ���ɳ�����������Һ����ǣ�
��2��a��AlCl3��CO2 ����Ӧ��
b��AlCl3�������������Ʒ�Ӧ����NaAlO2��Һ��
c��AlCl3��NaAlO2����˫ˮ�⣻
d��AlCl3��Na2CO3����˫ˮ�⣻
��3�����Թ��еμ���ҺʱӦ����ֱ�����ա������Թܼмг������Թ��ھƾ����ϼ���ʱ��Ҫ�����ƶ��Թܣ���ֹ�ֲ����У�
��4�����ж��Լ��ѹ����ķ����Ǽ����μӣ�����ˮ�������ʱ��ȥ�ϲ���Һ�����μӰ�ˮ�����������ɣ������õ�Al��OH��3������������2-3�Σ����������������0.1g��˵��Al��OH��3�ֽ���ȫ��Al2O3����ѡ��ⶨ����Al��OH��3�����������DzⶨAl2O3��������ԭ����Al��OH��3���ȶ��Բ���Al2O3�ã�
�ڵζ�����̶����Ϸ�����������0.01mL��
�۸���0.1120mol HNO3������������ԭ��3.490gAl2��OH��nCl��6-n����OH-���ĵĺͱ�0.1290mol/L�ı�NaOH��Һ���ģ��ݴ˼��㣮
��� �⣺��1���Ȼ����������Al3+��ˮ�⣬ˮ������H+��ˮ������ӷ���ʽΪ��Al3++3H2O?Al��OH��3+3H+������������������ˮ�⣬
�ʴ�Ϊ�������Ȼ�������Al3+��ˮ�⣻
��2��a��AlCl3��CO2 ����Ӧ������Һ��Ϊ���壬��a��ȷ��
b��AlCl3�������������Ʒ�Ӧ����NaAlO2��Һ��AlCl3+4NaOH=3NaCl+NaAlO2+2H2O���ó�����Һ����b��ȷ��
c��AlCl3��NaAlO2����˫ˮ�⣺AlCl3+3NaAlO2+6H2O=4Al��OH��3��+3NaCl���ò���������Һ����c����
d��AlCl3��Na2CO3����˫ˮ�⣺2AlCl3+3Na2CO3+3H2O=2Al��OH��3��+3CO2�����ò���������Һ����d����
�ʴ�Ϊ��ab��
��3�����Թ��еμ���ҺʱӦ����ֱ�����ա���Ŀ���Ƿ�ֹ��Ⱦ�Լ������Թܼмг������Թ��ھƾ����ϼ���ʱ��Ҫ�����ƶ��Թܷ�ֹ�ֲ����У�
�ʴ�Ϊ����ֹ�Լ�����Ⱦ����ֹ�ֲ��������𱩷У�
��4�����ж��Լ��ѹ����ķ����Ǽ����μӣ�������ˮ�������ʱ��ȥ�ϲ���Һ�����μӰ�ˮ�����������ɣ������õ�Al��OH��3������������2-3�Σ����������������0.1g��˵��Al��OH��3�ֽ���ȫ��Al2O3����ѡ��ⶨ����Al��OH��3�����������DzⶨAl2O3��������ԭ���Ǹ���Al��OH��3ʱ�ֽ�ʧˮ������Al2O3��ʧˮ������c���ϣ�
�ʴ�Ϊ�����ã����ϲ�[Һ�м����μӰ�ˮ���������ɣ�2��c��
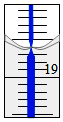
�ڵζ��ܵ�0�̶����ϣ��ʵζ��ܵĶ���Ϊ18.60mL�������ĵ��������Ƶ����Ϊ18.60mL��
�ʴ�Ϊ��18.60��
�۸���0.1120mol HNO3������������ԭ��3.490gAl2��OH��nCl��6-n����OH-���ĵĺͱ�0.1290mol/L�ı�NaOH��Һ���ģ����У�0.112mol=$\frac{3.490g}{��267-18.5n��g/mol}$��n+0.129mol/L��0.0186L��5�����n=5��
�ʴ�Ϊ��5��
���� ���⿼���������仯��������ʺ�����к͵ζ����й����ݣ��ۺ��Խ�ǿ��ע�������������ݵĴ�������Ŀ�Ѷ��еȣ�


 �������ϵ�д�
�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��п��ϡ���ᷴӦʱ��������CuSO4��Һ����ʹ��Ӧ���ʼӿ� | |
| B�� | ����������Լ�KOH��Һ���ɵ�����ȼ�ϵ���У������Ϸ����ķ�ӦΪCH4+8OH-+8e-�TCO2+6H2O | |
| C�� | ��ͭƬ����Ƭ������һ�����ϡH2SO4�У���Ƭ����������� | |
| D�� | ��ͭƬ����FeCl3��Һ�У���ͭƬ�������һ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ӧ�����Ҵ�������3mol/L����Ļ��Һ | |
| B�� | �¶ȼƲ��뷴Ӧ��ҺҺ�����£��Ա�����¶���140�� | |
| C�� | ��Ӧ��������ƿ����Ӧ����������Ƭ | |
| D�� | ��Ӧ���������ٴ�ˮ��ȡ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��֪���������ȶ���С���춡�飬��CH3CH2CH2CH3��g������CH3��2CHCH3��g����H��0 | |
| B�� | ��֪��OH-��ag��+H+��aq���TH2O��l����H=-57.4 kJ/mol��20.0g NaOH��ϡ��Һ��ϡ������ȫ�кͣ��ų�28.7kJ������ | |
| C�� | ��֪��2H2O��l���T2H2��g��+O2��g����H=+483.6 kJ•mol-1����������ȼ����Ϊ241.8kJ/mol | |
| D�� | ��֪��2C��s��+2O2��g���T2CO2��g����H1 2C��s��+O2��g��=2CO��g����H2�����H1����H2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢� | B�� | �ڢ� | C�� | �٢� | D�� | �ڢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ƽ�д��� | 1 | 2 | 3 |
| 0.250g��Ʒ�������������Һ�������mL�� | 24.35 | 24.05 | 23.95 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com